
Sábado, Junio 13, 2023
Los científicos de Salk desentrañan el rompecabezas "BAFfling" de cómo se desarrollan las células inmunitarias que combaten las infecciones y el cáncer en ratones
Los científicos de Salk desentrañan el rompecabezas "BAFfling" de cómo se desarrollan las células inmunitarias que combaten las infecciones y el cáncer en ratones
LA JOLLA—El sistema inmunitario protege al cuerpo de invasores, como bacterias, virus o tumores, con su intrincada red de proteínas, células y órganos. Las células inmunitarias especializadas, llamadas células T citotóxicas, pueden convertirse en células efectoras de vida corta que matan las células infectadas o cancerosas dentro de nuestro cuerpo. Una pequeña porción de esas células efectoras permanecen después de una infección y se convierten en células de memoria de mayor duración, que "recuerdan" las infecciones y responden cuando reaparecen. Pero se sabía poco sobre qué influye en las células T citotóxicas para transformarse en estos subtipos de células T efectoras y de memoria.
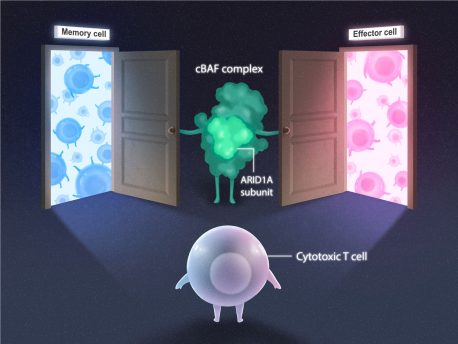
Ahora, profesor del Instituto Salk susana kaech y profesor asociado Diana Hargreaves han descubierto que un complejo proteico llamado cBAF puede abrir o cerrar "puertas" genéticas para controlar el destino de las células T. El estudio, publicado en Inmunidad el 13 de junio de 2023, ilustra cómo las células T combaten y recuerdan las infecciones y allana el camino para el desarrollo de vacunas y terapias contra el cáncer más eficaces.
“Hemos demostrado cómo las células T se transforman en subtipos especializados durante una infección y qué sucede cuando estropean el plan genético. Sin este modelo genético, es posible que las células T no puedan resolver o recordar infecciones, o posiblemente se vuelvan cancerosas, como vemos en el linfoma de células T”, dice Kaech, autor principal y coautor correspondiente, director del Centro NOMIS de Inmunobiología y Patogénesis Microbiana, y titular de la Cátedra NOMIS. "Descubrir que el complejo de proteínas cBAF es esencial para crear diferentes subtipos de células T abre nuevas preguntas, como ¿podemos controlar este proceso para optimizar la función de las células inmunitarias para la terapia del cáncer?"
La pregunta de cómo las células T citotóxicas se convierten en células T efectoras y de memoria puede responderse observando cómo se crean, un proceso que se basa en las instrucciones genéticas contenidas en la cromatina. La cromatina está compuesta por una mezcla de código genético (ADN) que funciona como instrucciones, así como proteínas y ARN que regulan y protegen esas instrucciones. La reorganización de la cromatina dentro de una célula expone u oculta diferentes secciones del código genético, alterando a su vez las instrucciones disponibles. Una vez que las instrucciones están disponibles, las proteínas llamadas factores de transcripción determinan si se leen y con qué frecuencia.
Los investigadores sabían que la cromatina funciona como un andamiaje, protegiendo el código genético interno y protegiéndolo de los factores de transcripción. Para que los factores de transcripción accedan a esas instrucciones, es probable que necesiten la ayuda del cBAF que remodela la cromatina, que puede señalar proteínas y ARN para revelar el código genético de los factores de transcripción.
"La remodelación de la cromatina es esencial para determinar la identidad de las células", dice el coautor Bryan McDonald, estudiante graduado en el laboratorio de Kaech. “En otros tipos de células, se sabía que el complejo de remodelación de cromatina cBAF desempeñaba un papel importante en la diferenciación celular. Queríamos saber si cBAF también era importante para la diferenciación de células T citotóxicas”.

El complejo cBAF está formado por muchas subunidades, incluida ARID1A. Para explorar el papel de ARID1A en la remodelación de la cromatina en las células T, el equipo examinó las células T con y sin subunidades ARID1A en ratones. Después de una infección viral de una semana (para instigar la respuesta inmune de las células T), los investigadores buscaron cambios en la estructura de la cromatina, la ubicación de las proteínas y la accesibilidad del código genético.
"El panorama de la cromatina evolucionó enormemente durante el curso de la infección", dice el coautor principal Brent Chick, estudiante graduado en el laboratorio de Hargreaves. "Los complejos cBAF que contienen la subunidad ARID1A fueron cruciales para reorganizar la cromatina para que los factores de transcripción pudieran acceder al código genético que instruye el desarrollo de diferentes subtipos de células T con funciones especializadas".
Sin ARID1A, las células T citotóxicas no podrían convertirse en el subtipo efector de respuesta rápida y de corta duración. La pérdida de ARID1A no impidió que las células T citotóxicas se convirtieran en su subtipo de memoria de vida más larga, pero las células de memoria creadas sin ARID1A no fueron tan efectivas para responder a una reinfección viral. Finalmente, la formación de células T de memoria que residen en órganos, como los pulmones o el intestino delgado, dependía de ARID1A. Sin ARID1A, las células T de memoria residentes en tejidos no podrían desarrollarse en absoluto.
ARID1A fue el jugador clave, como sospechaba el equipo. Y el mecanismo ahora estaba claro: durante las infecciones, los complejos cBAF con ARID1A abren diferentes "puertas" de cromatina para revelar el código genético a los factores de transcripción, que luego determinan el destino de las células T citotóxicas. El establecimiento de este nuevo mecanismo allana el camino para investigar cómo la remodelación de la cromatina, el código genético y los factores de transcripción juntos contribuyen a una respuesta exitosa del sistema inmunitario.
"Nuestra investigación demuestra que la eliminación de ARID1A de la ecuación de la respuesta inmunitaria puede dañar en gran medida nuestra capacidad para combatir infecciones", dice Hargreaves, coautor para la correspondencia y titular de la Cátedra de Desarrollo Dotada de Richard Heyman y Anne Daigle. “Espero que nuestros hallazgos inspiren nuevas preguntas en la investigación de enfermedades infecciosas y cáncer, y que hayamos demostrado el valor de hacer esas preguntas en colaboración”.
A continuación, los científicos planean examinar este mecanismo utilizando células T humanas. Además, su objetivo es discernir cómo las células T de memoria se ven afectadas por este proceso, ya que son valiosas herramientas de pronóstico para evaluar tumores humanos.
Otros autores incluyen a Nasiha Ahmed, Mannix Burns, Shixin Ma, Eduardo Casillas, Dan Chen, Thomas Mann, Carolynn O'Connor y Nasun Hah del Instituto Salk.
El trabajo fue apoyado por los Institutos Nacionales de Salud (F31HL158235, F99CA274688, 5T32GM133351, 2T32CA009370, R37 AI066232, AI151123, NCI CCSG: P30 014195), Pew-Stewart Scholars for Cancer Research, American Cancer Society Research Scholar Award, Cancer Research Institute, Damon Runyon Cancer Research Foundation, Shared Instrumentation Grant (S10-OD023689), Chapman Foundation y Helmsley Charitable Trust.
DOI: 10.1016 / j.immuni.2023.05.005
PERIODICO
Inmunidad
AUTORES
Autores: Bryan McDonald, Brent Y. Chick, Nasiha S. Ahmed, Mannix Burns, Shixin Ma, Eduardo Casillas, Dan Chen, Thomas H. Mann, Carolyn O'Connor, Nasun Hah, Diana C. Hargreaves, Susan M. Kaech
Oficina de Comunicaciones
Tel: (858) 453-4100
prensa@salk.edu
Descubrir los secretos de la vida misma es la fuerza impulsora detrás del Instituto Salk. Nuestro equipo de científicos galardonados de clase mundial traspasa los límites del conocimiento en áreas como neurociencia, investigación del cáncer, envejecimiento, inmunobiología, biología vegetal, biología computacional y más. Fundado por Jonas Salk, desarrollador de la primera vacuna contra la polio segura y eficaz, el Instituto es una organización de investigación independiente y sin fines de lucro y un hito arquitectónico: pequeño por elección, íntimo por naturaleza y valiente ante cualquier desafío.