
Sábado, Junio 24, 2015
En un hallazgo inesperado, el Instituto Salk y sus colaboradores muestran cómo la desactivación de la protección de los telómeros durante la división celular provoca la muerte celular
En un hallazgo inesperado, el Instituto Salk y sus colaboradores muestran cómo la desactivación de la protección de los telómeros durante la división celular provoca la muerte celular
LA JOLLA: los telómeros, extremos especializados de nuestros cromosomas que dictan cuánto tiempo las células pueden continuar duplicándose, se han estudiado durante mucho tiempo por sus vínculos con el proceso de envejecimiento y células cancerosas. Ahora, un descubrimiento en el Instituto Salk muestra que los telómeros pueden ser más centrales de lo que se pensaba anteriormente para un programa de autodestrucción en las células que previene los tumores, una función que podría explotarse potencialmente para mejorar las terapias contra el cáncer.
Cuando las células se replican en un proceso llamado mitosis, sus telómeros se acortan un poco cada vez. Eventualmente, después de muchas divisiones celulares, los telómeros se acortan críticamente, lo que indica a la célula que deje de dividirse. Este proceso normal funciona como una barrera contra el cáncer. Sin embargo, las células que tienen defectos en la vía de señalización continúan más allá de esta etapa para autodestruirse.
Este proceso de destrucción celular, llamado crisis, generalmente evita que las células genéticamente inestables o dañadas se reproduzcan. Pero muchos tipos de células cancerosas eluden la crisis al proteger los telómeros para obstaculizar la señal de autodestrucción y permitir que las células continúen proliferando.
“Nos propusimos comprender el mecanismo de la muerte celular en crisis y encontramos un papel mucho más activo de los telómeros como barreras para el desarrollo de tumores de lo que se pensaba anteriormente”, dice Jan Karlseder, Salk profesor en la Laboratorio de Biología Molecular y Celular y autor principal de la obra. “Comenzó cuando vimos que la mitosis es más larga en las células que se acercan a la crisis”. El trabajo fue detallado en Naturaleza de junio 24, 2015.
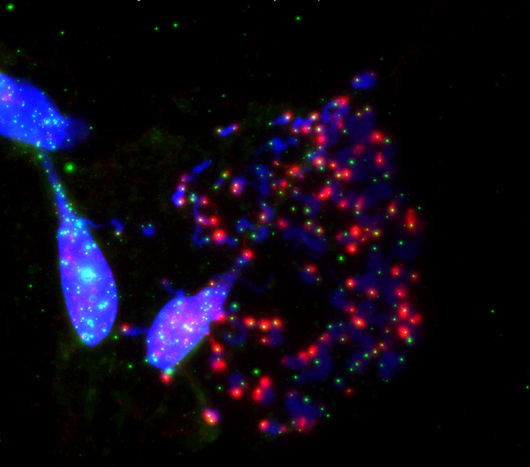
Los investigadores de Salk muestran cómo la protección desactivada de los extremos de los cromosomas (azul) llamados telómeros (verde) durante la división celular (mitosis) provoca la muerte celular. Esto sucede cuando se inhibe la proteína protectora de los telómeros, TRF2. Esta imagen muestra una exacerbación de la desprotección telomérica (rojo) durante la detención mitótica por manipulación artificial de TRF2.
Haga clic aquí para una imagen de alta resolución.
Imagen: Cortesía del Instituto Salk de Estudios Biológicos
Mientras que la mitosis normal suele durar entre 30 y 45 minutos, las células que están a punto de entrar en crisis tienen una mitosis que dura entre 2 y 20 horas o más. Observar esto les recordó a los investigadores una 2012 descubrimiento donde alargaron artificialmente el proceso de mitosis. Por lo general, los telómeros tienen una proteína que los protege de ser identificados como ADN dañado por la célula y, por lo tanto, evita que prosigan con la muerte celular. Pero durante la mitosis alargada artificialmente, los telómeros perdieron la proteína, lo que provocó una señal de daño en el ADN que empujó a las células a la autodestrucción.
Para su sorpresa, los científicos descubrieron que sucedía exactamente lo mismo en el estado de crisis natural. En este nuevo trabajo, los investigadores tomaron imágenes en tiempo real de las células en un plato para rastrear el destino de las células a través de uno o más ciclos mitóticos. Descubrieron que un tipo de estrés celular llamado fusión de telómeros podría provocar una mitosis prolongada y, finalmente, una crisis. Las células en este estado perdieron su proteína protectora de los telómeros y activaron la secuencia de autodestrucción.
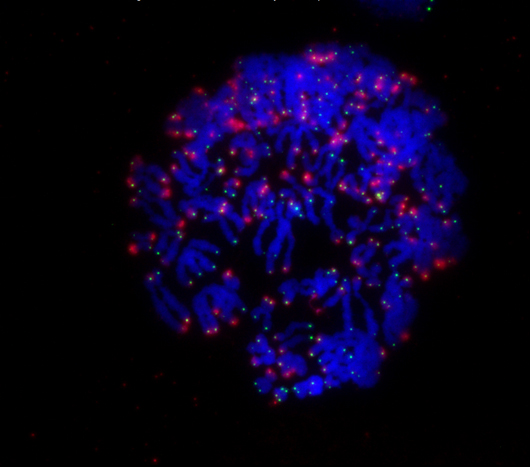
Durante la mitosis, los cromosomas de una célula (azul) se dividen rápidamente. Cuando los extremos de los cromosomas llamados telómeros (verde) ya no están protegidos por la proteína TRF2, la célula recibe una señal (rojo) para que sufra muerte celular.
Haga clic aquí para una imagen de alta resolución.
Imagen: Cortesía del Instituto Salk de Estudios Biológicos
“Hubo una hipótesis de larga data que resultó ser incorrecta: que las células simplemente comienzan a fusionar cromosomas y se rompen, generando inestabilidad y muerte celular”, dice Karlseder, quien también es titular de la cátedra Donald y Darlene Shiley de Salk. "Lo que mostramos, en cambio, es una vía mucho más específica que realmente solo toma un ciclo celular para causar una crisis; no tiene nada que ver con la acumulación lenta y constante de inestabilidad genómica".
Anthony Cesare, Jefe del Grupo de Integridad del Genoma en Instituto de Investigación Médica Infantil en Australia y colaborador del trabajo, dijo que el hallazgo fue muy emocionante y que fue inesperado ver cómo los eventos tempranos en el ciclo celular, las fusiones de telómeros, pasan a una etapa posterior del ciclo celular, la mitosis. “Esto abre nuevas vías para comprender cómo los telómeros controlan el crecimiento celular y las implicaciones de la biología de los telómeros en la quimioterapia”, dice.
Varias quimioterapias, como Taxol para el cáncer de mama, buscan detener el cáncer interrumpiendo la mitosis para que las células cancerosas ya no puedan dividirse. Los investigadores plantean la hipótesis de que pueden mejorar estos inhibidores mitóticos, por ejemplo, desprotegiendo primero los telómeros para hacer que las células sean más susceptibles a los fármacos. También podría ser posible ver si las células de un tumor en particular tenían telómeros más cortos o desprotegidos y, de ser así, esperar que el tumor sea mucho más sensible a los inhibidores mitóticos.
"La vía que hemos encontrado desafía una hipótesis de larga data sobre el comportamiento celular durante la formación temprana de tumores", dice Makoto Hayashi, investigador del Centro Hakubi de Investigación Avanzada de la Universidad de Kyoto y primer autor del nuevo trabajo. "Con suerte, la comprensión integral de la vía nos proporcionará un método novedoso para el diagnóstico temprano de tumores y una oportunidad terapéutica para las etapas muy tempranas del cáncer".
El laboratorio está trabajando actualmente con Deborah Kado, MD, MS, en la Universidad de California, San Diego, para probar estas teorías en pacientes con cáncer de mama recién diagnosticado.
Los autores del estudio son Makoto T. Hayashi de la Universidad de Kyoto, Anthony J. Cesare del Instituto de Investigación Médica Infantil y Teresa Rivera y Jan Karlseder del Instituto Salk.
Este trabajo fue financiado por la Programa de ciencias de la frontera humana y del Sociedad Japonesa para la Promoción de la Ciencia Becas Postdoctorales para la Investigación en el Extranjero, la Los Institutos Nacionales de Salud, la silla Donald y Darlene Shiley, la Fundación de la calle Highland, la Fundación Fritz B. Burns, la Fundación Esmeralda, y la Centro Glenn de Investigación sobre el Envejecimiento.
PERIODICO
Naturaleza
TÍTULO
La muerte celular durante la crisis está mediada por la desprotección de los telómeros mitóticos
AUTORES
Makoto T. Hayashi, Anthony J. Cesare, Teresa Rivera y Jan Karlseder
Oficina de Comunicaciones
Tel: (858) 453-4100
prensa@salk.edu
Descubrir los secretos de la vida misma es la fuerza impulsora detrás del Instituto Salk. Nuestro equipo de científicos galardonados de clase mundial traspasa los límites del conocimiento en áreas como neurociencia, investigación del cáncer, envejecimiento, inmunobiología, biología vegetal, biología computacional y más. Fundado por Jonas Salk, desarrollador de la primera vacuna contra la polio segura y eficaz, el Instituto es una organización de investigación independiente y sin fines de lucro y un hito arquitectónico: pequeño por elección, íntimo por naturaleza y valiente ante cualquier desafío.