
Marzo 11, 2012
El descubrimiento de los científicos de Salk explica cómo funciona una clase de medicamentos de quimioterapia
El descubrimiento de los científicos de Salk explica cómo funciona una clase de medicamentos de quimioterapia
LA JOLLA, CA—El bienestar de las células vivas requiere escuadrones especializados de proteínas que mantengan el orden. Los degradadores mastican las proteínas desgastadas, los recicladores envuelven los orgánulos dañados y, lo que es más importante, los equipos de reparación del ADN vuelven a coser cualquier cosa que parezca un cromosoma roto. Si la reparación es imposible, el capataz de la cuadrilla llama a los verdugos para aniquilar una celda. Por desagradable que suene este último grupo, el hecho de no convocarlos es un aspecto de lo que hace que una célula cancerosa sea una célula cancerosa.
Un estudio reciente de científicos del Instituto Salk de Estudios Biológicos mostró exactamente cómo las células perciben la posibilidad de que su ADN esté dañado como un primer paso para responder a la falta de división adecuada. Ese estudio, publicado el 11 de marzo en Naturaleza Biología Estructural y Molecular, descubrió que si las células tardan demasiado en dividirse, las estructuras en las puntas de sus cromosomas, conocidas como telómeros, envían una señal SOS molecular.

(De derecha a izquierda) Jan Karlseder, Profesor, Laboratorio de Biología Molecular y Celular y Makoto Hayashi, investigador asociado.
Imagen: Cortesía del Instituto Salk de Estudios Biológicos
Estos hallazgos tienen implicaciones duales para la quimioterapia del cáncer. Primero, muestran cómo una clase de medicamentos contra el cáncer que ralentiza la división celular, conocidos como inhibidores mitóticos, mata las células. Esta clase incluye los medicamentos de quimioterapia comunes vinblastina, taxol y velcade. Más significativamente, los hallazgos sugieren formas de hacer que la terapia con esos inhibidores sea más potente.
"Cómo funcionan los inhibidores mitóticos como terapia contra el cáncer ha sido una pregunta de hace 25 años", dice Jan Karlseder, profesor del Laboratorio de Biología Molecular y Celular de Salk y autor principal del estudio. “Estos medicamentos se usan ampliamente, pero no estaba claro por qué realmente matan las células cancerosas”.
El laboratorio de Karlseder lleva mucho tiempo fascinado por el papel que desempeñan los telómeros en el envejecimiento y el cáncer. A menudo descritos como el equivalente genómico de las tapas de plástico que evitan que los cordones de los zapatos se deshilachen, los telómeros forman una tapa protectora de proteína/ADN en cada extremo de los cromosomas lineales, enmascarando esos extremos de las proteínas de reparación vigilantes pero aparentemente miopes, que podrían confundir los extremos expuestos de los cromosomas con roturas. ADN.
Inicialmente, el grupo buscó proteínas específicas que pudieran mantener intactos los telómeros durante la división celular. Para hacerlo, eliminaron genéticamente las proteínas candidatas una por una y luego examinaron las células mediante microscopía de fluorescencia para detectar si los telómeros se dañaron. Lo que encontraron fue inesperado, a saber, que cualquier la manipulación que paralizó y prolongó la división celular produjo un mayor número de manchas de telómeros punteados indicativos de telómeros "desprotegidos".
El tratamiento de las células con inhibidores mitóticos utilizados en la quimioterapia contra el cáncer hizo exactamente lo mismo. Esos estudios establecieron un vínculo entre la mitosis detenida, la perturbación de los telómeros y la muerte celular.
Luego confirmaron que a medida que las células se estancaban en la mitosis, las tapas teloméricas de los cordones de los zapatos comenzaban a desintegrarse. “Normalmente, los extremos de los cromosomas están cubiertos por la proteína TRF2, que protege el telómero”, dice Makoto Hayashi, becario postdoctoral en el laboratorio de Karlseder y primer autor del estudio. “Pero descubrimos que, durante la detención mitótica, TRF2 se disocia de los telómeros, exponiendo los extremos cromosómicos como ADN dañado. Eso probablemente activa una señal de daño en el ADN”.
El factor decisivo llegó cuando los investigadores descubrieron que cuanto más tiempo soportaban las células el estrés de los telómeros, más masivamente inducían lo que debería ser el gen más preciado por todos, el supresor de tumores p53.
"Las señales de daño del ADN que se producen durante la detención mitótica probablemente predispongan a las células a regular al alza p53 en la siguiente fase", dice Hayashi. "Esto entonces detiene el ciclo celular para permitir que ocurra la reparación del ADN o compromete a las células a una vía suicida llamada 'apoptosis'".
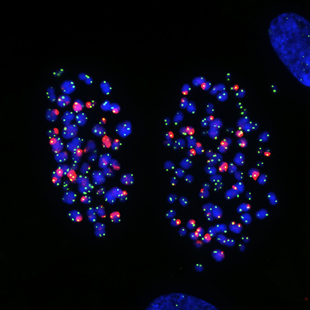
Esta imagen de microscopio muestra cromosomas en células pulmonares humanas que muestran daños en los telómeros causados por colcemid, un fármaco que detiene la división celular.
Los científicos de Salk descubrieron la vía molecular que inicia una respuesta de estrés tras el tratamiento con medicamentos de quimioterapia, lo que da como resultado el cese del crecimiento celular o la muerte celular.
Imagen: Cortesía de Jan Karlseder, Profesor, Laboratorio de Biología Molecular y Celular, Makoto Hayashi, investigador asociado y James Fitzpatrick, Centro de Biofotónica Avanzada Waitt
Karlseder señala que p53 y las proteínas que moviliza constituyen la vía de mutación más frecuente en el cáncer. "Una vía p53 funcional es un signo saludable, ya que es la primera respuesta de la célula a las roturas del ADN o la disfunción de los telómeros", dice, "sin ella, los cromosomas podrían volverse inestables y podrían fusionarse entre sí o romperse, lo que provocaría una pérdida de integridad del genoma y crecimiento descontrolado”.
Este trabajo sugiere estrategias novedosas que podrían usarse en regímenes de quimioterapia combinatoria contra el cáncer, que se basan en la sinergia entre dos o más fármacos. La teoría es que un enfoque múltiple podría tener más éxito que un mazo solo, como lo demuestra el "cóctel triple" altamente efectivo de medicamentos que ahora se usan para tratar el SIDA.
"Para hacer que la terapia sea más efectiva y reducir los efectos secundarios, podríamos usar niveles más moderados de inhibidores mitóticos, que en dosis altas pueden causar efectos secundarios graves, combinados con un fármaco diferente que sensibilice las células a la respuesta al daño del ADN", dice. Karlseder. “Eso podría mejorar las posibilidades de atrapar el 100 por ciento de las células tumorales”.
Antes de este estudio, los telómeros ya eran famosos por el hecho de que regulan el envejecimiento al actuar como un reloj celular, que marca la edad de una célula. “Cada vez que una célula se divide, se pierde un poco de la capa de telómero hasta que desaparece, lo que indica que las células no pueden dividirse más”, explica Karlseder. “Esta limitación asegura que las células no se vuelvan inmortales o cancerosas”.
Sin embargo, estudios recientes muestran que, entre otras actividades insidiosas, las células cancerosas descubren cómo retrasar el reloj de los telómeros y mantenerlas inmortales. “Hacen esto activando vías que específicamente alargan los telómeros”, dice Karlseder. "Estas vías, por lo tanto, representan un objetivo potencial importante para la terapia".
También contribuyeron a este estudio Anthony Cesare, del Karlseder Lab; James Fitzpatrick, director de la instalación central de biofotónica avanzada Waitt de Salk; y Eros Lazzerini-Denchi, del Instituto de Investigación Scripps en La Jolla.
Los fondos para el estudio provinieron de los Institutos Nacionales de Salud, el Programa de Ciencias de la Frontera Humana y la Sociedad Japonesa para la Promoción de la Ciencia.
Sobre el Instituto Salk de Estudios Biológicos:
El Instituto Salk de Estudios Biológicos es una de las instituciones de investigación básica más importantes del mundo, donde profesores de renombre internacional investigan cuestiones fundamentales de las ciencias de la vida en un entorno único, colaborativo y creativo. Centrados tanto en el descubrimiento como en la orientación de futuras generaciones de investigadores, los científicos de Salk realizan contribuciones innovadoras a nuestra comprensión del cáncer, el envejecimiento, el Alzheimer, la diabetes y las enfermedades infecciosas mediante el estudio de la neurociencia, la genética, la biología celular y vegetal y disciplinas relacionadas.
Los logros de la facultad han sido reconocidos con numerosos honores, incluidos premios Nobel y membresías en la Academia Nacional de Ciencias. Fundado en 1960 por el pionero de la vacuna contra la polio Jonas Salk, MD, el Instituto es una organización independiente sin fines de lucro y un hito arquitectónico.
PERIODICO
Naturaleza Biología Estructural y Molecular
AUTORES
Makoto T. Hayashi, Anthony J. Cesare, James AJ Fitzpatrick, Eros Lazzerini-Denchi y Jan Karlseder
Oficina de Comunicaciones
Tel: (858) 453-4100
prensa@salk.edu