
Febrero 17, 2016
El Instituto Salk y sus colaboradores muestran diferencias moleculares clave entre virus a medida que interactúan con el ADN del huésped
El Instituto Salk y sus colaboradores muestran diferencias moleculares clave entre virus a medida que interactúan con el ADN del huésped
LA JOLLA—Usando tecnología de imágenes de vanguardia, Salk Institute y Harvard Medical School Los investigadores han determinado la estructura de un complejo proteico que permite que virus similares al virus de inmunodeficiencia humana (VIH) establecen infecciones permanentes dentro de sus anfitriones.
Contrariamente a las suposiciones anteriores, la estructura del complejo de proteínas virales recientemente detallada indica que este tipo de arquitectura molecular difiere entre los retrovirus. Esta información ayuda a revelar cómo los retrovirus insertan su información genómica en las células humanas y puede tener implicaciones no solo para el tratamiento de enfermedades como el VIH, sino también para mejorar los métodos de terapia génica para entregar ADN nuevo a pacientes con mutaciones genéticas.
"Los detalles de cómo se integran los retrovirus difieren mucho más de lo que se pensaba anteriormente y conducen a patrones de infección completamente distintos", dice Dmitry Lyumkis, un becario salk y coautor principal del nuevo artículo, publicado en Naturaleza de febrero 18, 2016.
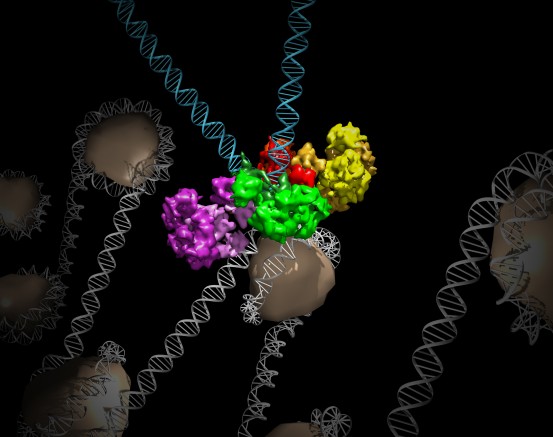
Haga clic aquí para una imagen de alta resolución.
Crédito: Instituto Salk
Un retrovirus inserta su información genética en el propio genoma del huésped, esencialmente convirtiendo las células del huésped en fábricas de producción de virus. En el caso del conocido retrovirus VIH, esos genes virales se integran en las células inmunitarias humanas y eventualmente las matan. Un misterio de larga data, causado en parte por la falta de conocimiento sobre la estructura compleja de la proteína, ha sido lo que dicta dónde se inserta el ADN viral en el genoma humano.
Un complejo de proteínas llamado intasoma es responsable de insertar irreversiblemente el ADN viral en el ADN humano, un paso vital para permitir que los retrovirus causen enfermedades. Dado que el interiorosoma del VIH en sí mismo es difícil de estudiar, la mayor parte de lo que se sabe sobre los intrasomas se basa en el trabajo de otro retrovirus llamado prototipo de virus espumoso o PFV. A la luz de los desafíos relacionados con las muestras relacionadas con los intasomas del VIH, Lyumkis y Engelman, junto con su colega Peter Cherepanov del Instituto Francis Crick, se propusieron determinar la estructura del intasoma del virus del tumor mamario de ratón (MMTV), que de alguna manera está más relacionado con el VIH que con el PFV.
"La estructura del intasoma MMTV define un paradigma novedoso inesperado para la base estructural de la integración del ADN retroviral", dice el coautor principal Alan Engelman, profesor de medicina en el Instituto del Cáncer Dana-Farber y la Facultad de Medicina de Harvard.
Para determinar la estructura molecular de MMTV, el equipo utilizó una técnica prometedora llamada microscopía crioelectrónica (cryoEM), un enfoque que tiene varias ventajas sobre las técnicas de imagen tradicionales. Por ejemplo, los investigadores no necesitan convertir las proteínas en formas cristalinas para obtener imágenes de ellas, un proceso impredecible que se requiere para la técnica más común de cristalografía de rayos X. En cryoEM, las proteínas se congelan directamente en una solución líquida. Luego, al medir cómo se desvían los haces de electrones de las muestras congeladas, los científicos pueden determinar la estructura de las proteínas.
Lyumkis usó esta tecnología de punta para detallar la estructura de los intasomas MMTV unidos a hebras de ADN viral (la forma en que se vería la estructura cuando invadiera una célula huésped). El equipo descubrió que mientras que el complejo PFV está compuesto por cuatro componentes proteicos, llamados integrasas, unidos a dos hebras de ADN viral, el ensamblaje MMTV tiene ocho moléculas de integrasa por cada dos fragmentos de ADN viral.
Esta diferencia estructural clave, dice Lyumkis, significa que los complejos interactúan de manera diferente con el ADN del huésped cuando están preparados para insertar ADN viral en el genoma. PFV prefiere puntos en el genoma del huésped que están muy doblados, mientras que MMTV elige tramos rectos de ADN. La preferencia por el VIH sigue siendo un misterio, pero las nuevas observaciones proporcionan un marco molecular inesperado dentro del cual interpretar los datos pasados y futuros sobre el VIH y otros retrovirus.
Los equipos de Lyumkis y Engelman ahora están trabajando para comprender la serie de eventos por los que pasa el complejo del intasoma MMTV durante los pasos de la integración viral, desde la unión del ADN viral hasta la captura del ADN del huésped y la catalización de la inserción del ADN viral en el genoma del huésped. Lyumkis también planea aplicar técnicas cryoEM para estudiar el propio complejo molecular del intasoma del VIH. “La infraestructura tecnológica está en su lugar, así que ahora creo que podemos abordar estos especímenes complicados y de mal comportamiento utilizando cryoEM”, agrega Lyumkis.
Otros investigadores del estudio fueron Allison Ballandras-Colas y Tamaria G. Dewdney del Dana-Farber Cancer Institute y la Escuela de Medicina de Harvard; Monica Brown del Instituto Salk; Nicola J. Cook y Peter Cherepanov de la Instituto Francis Crick; y Borries Demeler de la Centro de Ciencias de la Salud de la Universidad de Texas.
El trabajo y los investigadores involucrados fueron apoyados por subvenciones de la Los Institutos Nacionales de Salud, la Leona M. y Harry B. Helmsley Charitable Trust, la Fundación Nacional de Ciencias y el Instituto del Cáncer de San Antonio.
PERIODICO
Naturaleza
AUTORES
Allison Ballandras-Colas, Tamaria G. Dewdney y Alan Engelman de la Escuela de Medicina de Harvard; Monica Brown y Dmitry Lyumkis del Instituto Salk; Nicola J. Cook y Peter Cherepanov del Instituto Francis Crick; y Borries Demeler del Centro de Ciencias de la Salud de la Universidad de Texas
Oficina de Comunicaciones
Tel: (858) 453-4100
prensa@salk.edu
Descubrir los secretos de la vida misma es la fuerza impulsora detrás del Instituto Salk. Nuestro equipo de científicos galardonados de clase mundial traspasa los límites del conocimiento en áreas como neurociencia, investigación del cáncer, envejecimiento, inmunobiología, biología vegetal, biología computacional y más. Fundado por Jonas Salk, desarrollador de la primera vacuna contra la polio segura y eficaz, el Instituto es una organización de investigación independiente y sin fines de lucro y un hito arquitectónico: pequeño por elección, íntimo por naturaleza y valiente ante cualquier desafío.