
4 de mayo de 2017
La nueva tecnología Salk agrega grupos metilo en posiciones específicas del ADN, lo que permite la corrección genética específica de trastornos epigenéticos aberrantes
La nueva tecnología Salk agrega grupos metilo en posiciones específicas del ADN, lo que permite la corrección genética específica de trastornos epigenéticos aberrantes
LA JOLLA—Los científicos del Instituto Salk han desarrollado una tecnología novedosa para corregir las aberraciones que causan enfermedades en las etiquetas químicas del ADN que afectan la forma en que se expresan los genes. Estos tipos de modificaciones químicas, denominadas colectivamente epigenética o epigenoma, se consideran cada vez más tan importantes como la propia secuencia genómica en el desarrollo y la enfermedad.
La nueva tecnología Salk, que se describe en la revista Ciencia: el 4 de mayo de 2017, se utilizó para modelar mutaciones en el epigenoma asociado con el cáncer de colon y para restaurar los patrones de metilación adecuados en células madre derivadas de pacientes que padecen el síndrome de Angelman (AS), un trastorno neurodegenerativo poco frecuente que a menudo se diagnostica erróneamente como autismo. Además de modelar y tratar trastornos epigenéticos, la tecnología también es prometedora para estudiar el desarrollo humano y la biología en general.
“Estamos entusiasmados con la cantidad de nuevas vías que abre este trabajo para comprender los procesos de la enfermedad y desarrollar nuevas terapias efectivas”, dice el profesor Salk. Juan Carlos Izpisúa Belmonte, autor principal del artículo y titular de la Cátedra Roger Guillemin de Salk. “Descubrir cómo editar el genoma fue un gran paso; esta tecnología para editar el epigenoma es otro paso adelante”.
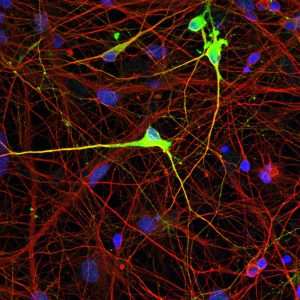
Haga clic aquí para una imagen de alta resolución. Crédito: Instituto Salk/Centro Waitt
Laboratorio de Izpisua Belmonte recientemente fue pionero en un método para modificar genes en células que no se dividen, que constituyen la mayoría de los tejidos adultos. La nueva técnica va más allá de los genes para apuntar al tipo más común de cambio epigenético, llamado metilación del ADN, en el que las etiquetas químicas llamadas grupos metilo se adhieren al ADN. Por lo general, estas etiquetas marcan el gen como listo para activarse o desactivarse. Cada vez más, los científicos están aprendiendo que la metilación del ADN está involucrada en una variedad de procesos fisiológicos y patológicos desde el desarrollo embrionario hasta la aparición de ciertas enfermedades más adelante en la vida, incluido el cáncer. Los investigadores han descubierto formas de alterar el estado de metilación en secuencias cortas de ADN, pero nadie ha sido capaz de hacer que los cambios se mantengan en un amplio rango (un requisito previo para la activación o desactivación adecuada de genes) hasta ahora.
Debido a que el 80 por ciento del ADN de los mamíferos está metilado, el laboratorio de Izpisua Belmonte sintió curiosidad por las regiones que no están metiladas. Paradójicamente, estas regiones a menudo son ricas en sitios de metilación potenciales y tienden a estar cerca de las regiones de los genes donde comienza la transcripción de la información genética. Sin embargo, de alguna manera estas regiones, que se denominan islas CpG, normalmente permanecen sin metilar.
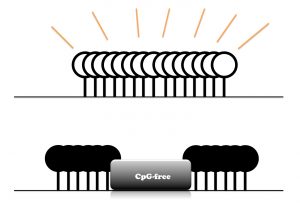
Haga clic aquí para una imagen de alta resolución
Crédito: Instituto Salk
Los investigadores plantearon la hipótesis de que interferir con las islas CpG podría desencadenar una nueva metilación. Para probar esta hipótesis, el equipo primero utilizó herramientas moleculares para insertar ADN sin CpG en la isla cercana a la MLH1 . MLH1 normalmente no está metilado, pero aumenta el riesgo de cáncer de colon si se metila. El equipo pudo imitar la metilación aberrante en el gen del cáncer de colon como prueba de principio para comenzar a comprender cómo la metilación anormal se asocia con los cánceres.
"Lo interesante de las islas CpG es que resisten la metilación", dice Yuta Takahashi, investigador asociado de Salk y primer autor del artículo. “Pero al introducir ADN libre de CpG, podemos anular la maquinaria que lo bloquea y luego inducir la metilación del ADN de toda la isla”.
Sabiendo que podrían inducir la metilación donde no pertenece, el equipo luego intentó colocar etiquetas de metilo donde pertenecen en un genoma pero faltan, como en algunas enfermedades. El síndrome de Angelman (AS) es el resultado de una metilación aberrante del ADN, que provoca una pérdida de la proteína UBE3A en las neuronas. Esto conduce a déficits cognitivos en los pacientes. Mediante el uso de su tecnología, el equipo corrigió la metilación anormal del ADN y restableció los niveles de proteína UBE3A en células neuronales AS en un plato.

Haga clic aquí para una imagen de alta resolución. Crédito: Instituto Salk
Lo más emocionante, según los investigadores, fue el hecho de que todos los patrones de metilación que introdujeron fueron estables a lo largo del tiempo, lo que no ha ocurrido con otras tecnologías epigenéticas. Incluso la eliminación del ADN libre de CpG no afectó a la nueva metilación. El hallazgo ofrece una forma de reescribir las marcas epigenéticas en las islas CpG, además de proporcionar información sobre el mecanismo por el cual las islas CpG están protegidas de la metilación del ADN.
"Es maravilloso que hayamos desarrollado una nueva tecnología que permite una edición robusta del metiloma del ADN en las islas CpG en células madre pluripotentes, lo que ayudará a desarrollar terapias de reemplazo celular para los trastornos epigenéticos", dice Jun Wu, científico del personal de Salk y uno de los de los coautores del artículo. “Pero al descubrir los mecanismos subyacentes de la metilación del ADN, esperamos hacer aún más con esta tecnología”.
Otros autores incluyeron a Keiichiro Suzuki, Paloma Martinez Redondo, Mo Li, Hsin-Kai Liao, Min-Zu Wu, Reyna Hernández-Benítez, Tomoaki Hishida, Maxim Nikolaievich Shokhirev, Concepcion Rodriguez Esteban e Ignacio Sancho-Martinez del Salk Institute.
El trabajo fue financiado por la NIH–Instituto Nacional del Cáncer (NCI), el Fundación Chapman, y el Leona M. y Harry B. Helmsley Charitable Trust, UCAM y del Fundación benéfica G. Harold y Leila Y. Mathers.
PERIODICO
Ciencia:
AUTORES
Yuta Takahashi, Jun Wu, Keiichiro Suzuki, Paloma Martinez-Redondo, Mo Li, Hsin-Kai Liao, Min-Zu Wu, Reyna Hernández-Benítez, Tomoaki Hishida, Maxim Nikolaievich Shokhirev, Concepcion Rodriguez Esteban, Ignacio Sancho-Martinez, Juan Carlos Izpisúa Belmonte
Oficina de Comunicaciones
Tel: (858) 453-4100
prensa@salk.edu
Descubrir los secretos de la vida misma es la fuerza impulsora detrás del Instituto Salk. Nuestro equipo de científicos galardonados de clase mundial traspasa los límites del conocimiento en áreas como neurociencia, investigación del cáncer, envejecimiento, inmunobiología, biología vegetal, biología computacional y más. Fundado por Jonas Salk, desarrollador de la primera vacuna contra la polio segura y eficaz, el Instituto es una organización de investigación independiente y sin fines de lucro y un hito arquitectónico: pequeño por elección, íntimo por naturaleza y valiente ante cualquier desafío.