
3 de noviembre.
Los investigadores de Salk encuentran que las neuronas navegan por el cuerpo de una manera que está influenciada por los genes que controlan las células de los vasos sanguíneos, que las neuronas necesitan y se interponen en su camino.
Los investigadores de Salk encuentran que las neuronas navegan por el cuerpo de una manera que está influenciada por los genes que controlan las células de los vasos sanguíneos, que las neuronas necesitan y se interponen en su camino.
LA JOLLA—Cuando se forman las neuronas involucradas en el movimiento, llamadas neuronas motoras, deben construir conexiones que van desde el cerebro, el tronco encefálico o la médula espinal hasta la cabeza, los brazos o la punta de los dedos de los pies. La forma en que las neuronas navegan por estos sistemas y "deciden" dónde y cómo crecer ha sido en gran medida un misterio.
Ahora, un nuevo estudio colaborativo entre científicos del Instituto Salk y colegas del Instituto Científico San Raffaele en Italia muestra cómo los genes de los vasos sanguíneos juegan un papel fundamental en el desarrollo de las neuronas motoras al decirles a los vasos sanguíneos que se aparten del camino.
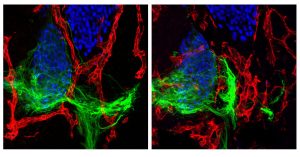
Los hallazgos, publicados el 7 de octubre de 2022 en la revista Neurona, brindan una nueva comprensión de cómo una relación de "empujar y jalar" con los vasos sanguíneos, en la que las neuronas en crecimiento atraen vasos sanguíneos hacia ellas y al mismo tiempo los apartan, guía el crecimiento y el desarrollo de las neuronas motoras y, potencialmente, un amplia variedad de tipos de células en todo el cuerpo. El descubrimiento también tiene implicaciones para comprender las enfermedades en las que se destruyen las conexiones de las neuronas motoras, como la esclerosis lateral amiotrófica (ELA) o la atrofia muscular espinal (SMA).
"Este descubrimiento revela un conjunto de interacciones moleculares y celulares que no se habían entendido antes", dice el coautor correspondiente. samuel pff, profesor en el Laboratorio de Expresión Génica y titular de la Cátedra Benjamin H. Lewis en Salk. “Nuestro descubrimiento de cómo estos genes regulan el crecimiento de los vasos sanguíneos y el desarrollo de las neuronas tiene implicaciones que van desde comprender cómo se forman otros circuitos cerebrales hasta comprender cómo las células cancerosas interactúan con su entorno”.
Las conexiones de las neuronas motoras se forman durante el desarrollo fetal. Este proceso de cableado del sistema nervioso es exquisitamente preciso, con células que hacen trillones de conexiones que se extienden por todo el cuerpo. Y, sin embargo, el proceso genético que dirige este desarrollo aún no se comprende bien.
La investigación anterior se ha centrado en el papel de genes específicos directamente relacionados con las neuronas motoras y cómo crecen. Pero para este estudio, los científicos adoptaron un enfoque más amplio, observando los genes tanto dentro como fuera del sistema nervioso.

Los investigadores aleatorizaron mutaciones genéticas en ratones y examinaron de cerca las neuronas motoras en desarrollo de los animales. Para su sorpresa, encontraron que los ratones cuyas neuronas motoras no crecían correctamente tenían mutaciones que no afectaban al sistema nervioso sino al sistema vascular, que incluye los vasos sanguíneos.
En ratones sanos, las neuronas motoras pueden crecer desde la médula espinal y navegar a través de los tejidos circundantes para llegar a grupos musculares distantes. Sin embargo, los científicos observaron que en los ratones con mutaciones vasculares, las neuronas motoras parecían quedar atrapadas detrás de una barrera de vasos sanguíneos. Descubrieron que la mutación había afectado la capacidad de los vasos sanguíneos para detectar las neuronas que se acercaban y apartarse del camino.
"Hay una colisión entre los axones en crecimiento y las células vasculares", dice el coautor correspondiente Dario Bonanomi, líder del grupo de neurobiología molecular en el Instituto Científico San Raffaele en Milán, Italia, y anteriormente de Salk. “Cuando quitas este receptor de las células de los vasos sanguíneos, los axones motores chocan con los vasos sanguíneos y su avance hacia los músculos se ve afectado y bloqueado”.
El hallazgo ilumina la delicada danza de las neuronas en desarrollo, que necesitan atraer vasos sanguíneos para impulsar su crecimiento, al mismo tiempo que los repele para que se aparten del camino. Es relevante para abordar los obstáculos que deben superarse en el desarrollo de la "terapia de reemplazo" de neuronas motoras utilizando células madre, un tratamiento potencial para enfermedades en las que las neuronas motoras degeneran, incluidas la ELA y la AME.
En el futuro, los científicos planean examinar la "diafonía" entre los nervios y los vasos sanguíneos en otros contextos, así como la forma en que los sistemas nervioso y vascular responden a los accidentes cerebrovasculares, las lesiones cerebrales y las enfermedades degenerativas como la ELA y la AME.
Otros autores incluyeron a Neal D. Amin de Salk; Luis F. Martins, Ilaria Brambilla, Alessia Motta, Stefano de Pretis, Ganesh Parameshwar Bhat, Aurora Badaloni y Chiara Malpighi del Instituto Científico San Raffaele en Italia; Fumiyasu Imai y Yutaka Yoshida del Instituto Neurológico Burke de Nueva York; y Ramiro D. Almeida de la Universidad de Coimbra en Portugal.
Este trabajo fue financiado por el Consejo Europeo de Investigación (subvención 335590), el Premio de Desarrollo Profesional de la Fundación Giovanni Armenise-Harvard, el Premio al Investigador del Instituto Médico Howard Hughes, el Instituto Nacional de Trastornos Neurológicos y Accidentes Cerebrovasculares (RO1 NS123160-01), el Premio Sol Goldman Charitable Trust, y la Cátedra Benjamin H. Lewis en Neurociencia.
DOI: https://doi.org/10.1016/j.neuron.2022.09.021
PERIODICO
Neurona
AUTORES
Luis F. Martins, Ilaria Brambilla, Alessia Motta, Stefano de Pretis, Ganesh Parameshwar Bhat, Aurora Badaloni, Chiara Malpighi, Neal D. Amin, Fumiyasu Imai, Ramiro D. Almeida, Yutaka Yoshida, Samuel L. Pfaff, Dario Bonanomi
Oficina de Comunicaciones
Tel: (858) 453-4100
prensa@salk.edu
Descubrir los secretos de la vida misma es la fuerza impulsora detrás del Instituto Salk. Nuestro equipo de científicos galardonados de clase mundial traspasa los límites del conocimiento en áreas como neurociencia, investigación del cáncer, envejecimiento, inmunobiología, biología vegetal, biología computacional y más. Fundado por Jonas Salk, desarrollador de la primera vacuna contra la polio segura y eficaz, el Instituto es una organización de investigación independiente y sin fines de lucro y un hito arquitectónico: pequeño por elección, íntimo por naturaleza y valiente ante cualquier desafío.