
Abril 21, 2022
El estudio de Salk apunta hacia un posible nuevo objetivo terapéutico para la pancreatitis y el cáncer de páncreas
El estudio de Salk apunta hacia un posible nuevo objetivo terapéutico para la pancreatitis y el cáncer de páncreas
LA JOLLA—Todos los días, su páncreas produce alrededor de una taza de jugos digestivos, una mezcla de moléculas que pueden descomponer los alimentos que ingiere. Pero si estas poderosas moléculas se activan antes de llegar al intestino, pueden dañar el páncreas mismo, digiriendo las mismas células que las crearon, lo que lleva a la dolorosa inflamación conocida como pancreatitis y predispone a una persona al cáncer de páncreas.
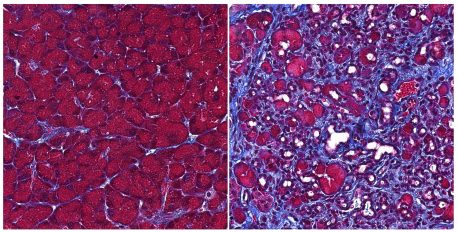
Ahora, los científicos de Salk informan en la revista Gastroenterología el 21 de abril de 2022, que una proteína conocida como receptor gamma relacionado con el estrógeno (ERR ɣ) es fundamental para prevenir la autodigestión pancreática en ratones. Además, descubrieron que las personas con pancreatitis tienen niveles más bajos de ERR ɣ en las células afectadas por esta inflamación.
Estos hallazgos sugieren que las nuevas terapias dirigidas a regular la actividad de ERR ɣ podrían ayudar a prevenir o tratar la pancreatitis y el cáncer de páncreas.
"Nuestro hallazgo proporciona una nueva perspectiva tanto de la biología básica de cómo funcionan las células del páncreas como de lo que podría provocar la pancreatitis y el cáncer de páncreas", dice el profesor. ronald evans, director del Laboratorio de Expresión Génica de Salk, Cátedra de Biología Molecular y del Desarrollo de March of Dimes, y coautor principal del estudio.
El páncreas alberga dos tipos de células principales con funciones distintas: las células beta que liberan insulina para controlar los niveles de azúcar en la sangre y las células acinares que producen los jugos digestivos. Evans y sus colegas descubierto previamente que ERR ɣ ayuda a las células beta pancreáticas a liberar insulina y podría ser útil como tratamiento para la diabetes. En estudios de seguimiento, el equipo también descubrió que los ratones que carecían de ERR ɣ desarrollaron pancreatitis grave.
Para comprender el papel de ERR ɣ en las células acinares pancreáticas, los investigadores compararon ratones, así como células aisladas, con y sin la proteína. Descubrieron que se requiere ERR ɣ para el funcionamiento de las mitocondrias de las células acinares, orgánulos que generan energía.

"Se sabe que las mitocondrias son la principal fuente de energía en las células acinares desde la década de 1960, pero el factor que controla este programa de producción de energía vital en las células acinares ha sido un misterio de larga data", dice el coautor principal Jae Myoung Suh de el Instituto Avanzado de Ciencia y Tecnología de Corea (KAIST), en Corea del Sur.
Sin ERR ɣ, las células acinares no solo tienen una regulación energética desregulada, sino que, como resultado, activan incorrectamente las enzimas digestivas para iniciar la autodigestión.
"Las mitocondrias en estas células tienen que ser particularmente robustas", dice el científico del personal Michael Downes, coautor del nuevo trabajo. “Si las cosas salen mal, esas enzimas digestivas se activan y luego comienza la autodigestión del páncreas”.
El grupo demostró que no solo comenzaba la autodigestión de las células acinares pancreáticas en ausencia de ERR ɣ, sino también los cambios celulares que indican cáncer pancreático temprano.
Luego, los investigadores recurrieron a los datos de pacientes con pancreatitis para determinar si los resultados del ratón y del laboratorio son relevantes para la enfermedad humana. Compararon las biopsias de pancreatitis con las obtenidas de células pancreáticas normales, incluidas secciones sanas del páncreas en los mismos pacientes. Descubrieron que las células afectadas por pancreatitis tenían niveles más bajos de ERR ɣ.
"Examinamos los datos en múltiples ubicaciones diferentes y grupos de pacientes y descubrimos que ERR ɣ está disminuyendo de manera muy constante con la pancreatitis", dice el coautor Tae Gyu Oh, analista de bioinformática en Salk.

Oh y sus colegas demostraron que los niveles de otros 83 genes, muchos de los cuales están directamente regulados por ERR ɣ, también estaban alterados en las muestras de pancreatitis. Además, cuando buscaron en los datos de dos grandes estudios que compararon la expresión génica en personas, descubrieron que algunos de esos 83 genes están asociados con tipos raros de pancreatitis hereditaria y cáncer de páncreas.
“El hecho de que esto se relacionara con pacientes con pancreatitis crónica sugiere que ERR ɣ es clínicamente relevante y podría ser un buen objetivo farmacológico en el futuro”, dice Evans.
Los investigadores están planificando estudios futuros para analizar en profundidad los cambios precancerosos a los que conducen la desregulación de ERR ɣ y la pancreatitis, así como también cómo los medicamentos podrían ayudar a aumentar ERR ɣ para prevenir o tratar enfermedades pancreáticas.
Otros autores incluyen a Weiwei Fan, Sagar P. Bapat, Ye Zheng, Ruth T. Yu, Annette Atkins y Eiji Yoshihara de Salk; Jinhyuk Choi, Heewon Jung, Kun-Young Park, Hyemi Shin, Taehee Jo, Du-Seock Kang, Sujung Hong y Pilhan Kim de KAIST; Dipanjan Chanda e In-Kyu Lee del Hospital Universitario Nacional Kyungpook; Jina Kim y Sung Jin Cho de la Fundación de Innovación Médica Daegu-Gyeongbuk; Moongi Ji y Man-Jeong Paik de la Universidad Nacional de Sunchon; Minkyo Jung y Ji Young Mun del Instituto de Investigación del Cerebro de Corea; Takashi Syoji de la Universidad de Kioto; Ayami Matsushima de la Universidad de Kyushu; David C. Whitcomb, Phil Greer y Brandon Blobner de la Universidad de Pittsburgh; Mark O. Goodarzi y Stephen J. Pandol del Centro Médico Cedars-Sinai; Jerome I. Rotter de UCLA; Christopher Liddle de la Universidad de Sydney; así como todo el Consorcio North American Pancreatitis Study 2 (NAPS2).
El trabajo fue apoyado en parte por el Instituto Nacional de Diabetes y Enfermedades Digestivas y Renales (T32 DK063922-17, NIH DK061451 y R01DK120480), el Centro Nacional de Recursos de Investigación (UL1 RR024153 y UL1TR000005), NIH Roadmap for Medical Research, Howard Hughes Medical Institute, Lustgarten Foundation, NOMIS Foundation, SWCRF Investigator Award, David C. Copley Foundation y Don and Lorraine Freeberg Foundation.
DOI: 10.1053 / j.gastro.2022.04.013
PERIODICO
Gastroenterología
AUTORES
Jinhyuk Choi, Tae Gyu Oh, Heewon Jung, Kun-Young Park, Hyemi Shin, Taehee Jo, Du-Seock Kang, Dipanjan Chanda, Sujung Hong, Jina Kim, Moongi Ji, Minkyo Jung, Takashi Syoji, Ayami Matsushima, Pilhan Kim, Ji Young Mun, Man-Jeong Paik, Sung Jin Cho, In-Kyu Lee, David C. Whitcomb, Phil Greer, Brandon Blobner, Mark O. Goodarzi, Stephen J. Pandol, Jerome I. Rotter, North American Pancreatitis Study 2 ( NAPS2), Weiwei Fan, Sagar P. Bapat, Ye Zheng, Christopher Liddle, Ruth T. Yu, Annette Atkins, Michael Downes, Eiji Yoshihara, Ronald M. Evans y Jae Myoung Suh
Oficina de Comunicaciones
Tel: (858) 453-4100
prensa@salk.edu
Descubrir los secretos de la vida misma es la fuerza impulsora detrás del Instituto Salk. Nuestro equipo de científicos galardonados de clase mundial traspasa los límites del conocimiento en áreas como neurociencia, investigación del cáncer, envejecimiento, inmunobiología, biología vegetal, biología computacional y más. Fundado por Jonas Salk, desarrollador de la primera vacuna contra la polio segura y eficaz, el Instituto es una organización de investigación independiente y sin fines de lucro y un hito arquitectónico: pequeño por elección, íntimo por naturaleza y valiente ante cualquier desafío.