
Abril 17, 2019
Los investigadores de Salk descubren un objetivo terapéutico potencial para el cáncer mortal
Los investigadores de Salk descubren un objetivo terapéutico potencial para el cáncer mortal
LA JOLLA: el cáncer de páncreas avanzado a menudo no presenta síntomas, lo que lleva a un diagnóstico tardío solo después de que las metástasis se han diseminado por todo el cuerpo. Además, las células tumorales están encerradas en un "escudo protector", un microambiente que les confiere resistencia a muchos medicamentos para el tratamiento del cáncer. Ahora, los investigadores del Instituto Salk, junto con un equipo internacional de colaboradores, han descubierto el papel de una proteína de señalización que puede ser el talón de Aquiles del cáncer de páncreas.
Los resultados, publicados en Naturaleza el 17 de abril de 2019, muestran que las células estrelladas pancreáticas (células residentes típicamente inactivas en el tejido normal) se activan y secretan proteínas para formar un caparazón alrededor del tumor en un intento de aislarlo y contenerlo. Las células estrelladas activadas también secretan una proteína de señalización llamada LIF, que transmite señales estimulantes a las células tumorales para impulsar el desarrollo y la progresión del cáncer de páncreas. Los resultados también sugieren que LIF puede ser un biomarcador útil para ayudar a diagnosticar el cáncer de páncreas de manera más rápida y eficiente.
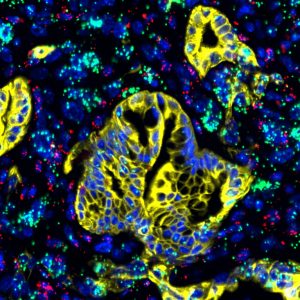
Haga clic aquí para una imagen de alta resolución.
Crédito: Instituto Salk
"No ha habido muchos avances en la terapia del cáncer de páncreas porque es un cáncer difícil de diagnosticar y tratar", dice el profesor de la Sociedad Estadounidense del Cáncer Salk. Tony Hunter. "Comprender esta red de comunicación entre las células cancerosas y las células estrelladas puede permitirnos desarrollar terapias más efectivas, junto con herramientas para un diagnóstico más temprano".
Los Institutos Nacionales de Salud (NIH, por sus siglas en inglés) proyectan que el cáncer de páncreas será la segunda causa principal de muertes relacionadas con el cáncer en los Estados Unidos para 2030. El año pasado, los NIH informaron aproximadamente 55,000 44,000 nuevos casos de cáncer de páncreas con más de XNUMX XNUMX muertes por enfermedad.
“La mayoría de los cánceres sólidos no son causados por anomalías en un solo tipo de célula. En cambio, las células tumorales viven y trabajan en cooperación con las células normales circundantes en el tejido. También pueden 'estropearse' juntos como una alianza profana, lo que puede conducir al cáncer”, dice Yu Shi, becario postdoctoral en Salk y primer autor del artículo. "Si podemos entender cómo los diferentes tipos de células interactúan entre sí dentro del microambiente tumoral, entonces podemos descubrir un buen objetivo para curar la enfermedad".
Para comprender el método de comunicación entre las células estrelladas pancreáticas y las células cancerosas, los investigadores primero desarrollaron cultivos celulares para analizar las proteínas que se exportaban desde las células estrelladas. Sospechaban que las células estrelladas se comunicaban con las células tumorales utilizando proteínas de señalización específicas, pero hasta ahora no sabían cuáles.
“Queríamos ver qué tipo de señalización se activaba en las células tumorales en el cáncer de páncreas”, dice Shi. “LIF es un factor importante que normalmente ayuda a las células madre a mantener su potencial de desarrollo durante el período embrionario, pero generalmente desaparece en la edad adulta. Descubrimos que las células estrelladas activadas secretan LIF, que actúa sobre las células cancerosas vecinas”.
Después de identificar a LIF como el comunicador crítico, los investigadores querían comprender mejor la función de LIF durante la progresión del cáncer de páncreas para evaluar la proteína como un objetivo terapéutico potencial. Al observar los efectos sobre el crecimiento tumoral del bloqueo o la destrucción de LIF (ambos hacen que la proteína no sea funcional) en un modelo de ratón con cáncer de páncreas, los investigadores pudieron examinar cómo LIF afecta la progresión del tumor y la respuesta al tratamiento. Ambas técnicas demostraron de forma independiente que sin la señalización funcional de LIF, la progresión del tumor se ralentizaba y mejoraban las respuestas a los fármacos quimioterapéuticos utilizados en el tratamiento del cáncer humano (como la gemcitabina).

Haga clic aquí para una imagen de alta resolución.
Crédito: Instituto Salk
"Estudios anteriores han demostrado que si matas las células estrelladas pancreáticas, los tumores empeoran", dice Hunter, titular de la Cátedra Renato Dulbecco en Salk. "Esto significa que no desea destruir las células estrelladas del páncreas que secretan factores de señalización, sino evitar que entreguen las señales estimulantes a las células tumorales".
Además de comprobar las consecuencias del bloqueo de LIF en ratones, los investigadores también examinaron los niveles de LIF en tejido tumoral y sangre de pacientes humanos con cáncer de páncreas. Encontraron altos niveles de LIF tanto en los tumores como en la sangre de los pacientes. También encontraron una correlación significativa entre los niveles de LIF, la progresión del tumor y la respuesta del paciente a la quimioterapia. Estos primeros hallazgos sugieren que LIF es prometedor como biomarcador para el estadio del cáncer de páncreas y la respuesta al tratamiento.
“Nos entusiasmó descubrir que los niveles elevados de LIF estaban significativamente correlacionados con el estado de las células tumorales y la respuesta a la quimioterapia”, agrega Shi. “Estos resultados son consistentes tanto en el modelo de ratón como en el cáncer de páncreas humano”.
Actualmente, el único biomarcador aprobado por la FDA para el cáncer de páncreas es un carbohidrato llamado CA19-9. Este estudio encontró que LIF era una medida precisa e independiente del cáncer de páncreas y era un mejor indicador de la respuesta terapéutica que CA19-9.
"Una posibilidad sería usar una combinación de los dos biomarcadores para obtener una mejor imagen del estado de la enfermedad y la respuesta", dice Hunter. “También pensamos que la terapia con anticuerpos anti-LIF podría ser útil, en combinación con otras terapias, para tratar el cáncer de páncreas. Esta es una investigación muy traducible, y es agradable trabajar en un proyecto que tiene la capacidad de tener un impacto directo en un cáncer humano mortal”.
Basado en parte en el descubrimiento del grupo Hunter de la función del LIF en el cáncer de páncreas, Northern Biologics, una empresa canadiense, inició un ensayo clínico de fase 1 para probar el efecto del tratamiento con un anticuerpo monoclonal (sintético) que se une y bloquea la señalización de LIF en el cáncer de páncreas avanzado y otros tipos de cáncer. Los resultados de este ensayo se esperan con gran interés, según Hunter.
Otros autores involucrados en el estudio fueron Weina Gao, Peiwu Huang, Xiao Yuan y Ruijun Tian de la Universidad de Ciencia y Tecnología del Sur; Nikki K. Lytle, Andrew M. Lowy y Tannishtha Reya de la Facultad de Medicina de la Universidad de California en San Diego; Miriam Scadeng de la Universidad de California en San Diego; Amanda M. Dann y Timothy R. Donahue de la Escuela de Medicina David Geffen de la Universidad de California en Los Ángeles; Maya Ridinger, Kathleen E. DelGiorno, Corina E. Antal, Gaoyang Liang, Annette R. Atkins, Galina Erikson, Huaiyu Sun, Jill Meisenhelder, Elena Terenziani, Gyunghwi Woo, Linjing Fang, Thom P. Santisakultarm, Uri Manor, Mathias Leblanc, Michael Downes, Ronald M. Evans y Geoffrey M. Wahl de Salk; Ruilian Xu del Hospital Popular de Shenzhen; Carlos R. Becerra del Texas Oncology-Baylor University Medical Center; Erkut Borazanci y Daniel D. Von Hoff del Instituto de Investigación de Genómica Traslacional y HonorHealth; Paul M. Grandgenett y Michael A. Hollingsworth del Instituto Eppley para la Investigación del Cáncer y Enfermedades Afines del Centro Médico de la Universidad de Nebraska; Sarah E. Umetsu y Eric A. Collisson de la Universidad de California, San Francisco; y Tony Pawson del Instituto de Investigación Lunenfeld-Tanenbaum, Hospital Mount Sinai y Departamento de Genética Molecular de la Universidad de Toronto.
El trabajo fue financiado por subvenciones del Ministerio de Ciencia y Tecnología de China (2016YFA0501403), Fundación Nacional de Ciencias Naturales de China (21575057), subvenciones NIH (CA014195, CA082683, CA080100, CA178015, CA227807, CA222862, CA197699, CA186043, CA155620 50, P127297CA01, U210240CA30, P36727CA5 y 50R211462CA388246), el Premio de la Fundación Lustgarten (552873 y 2012), la subvención de Leona M. and Harry B. Helmsley Charitable Trust (002-PG-MED2), la subvención de la Fundación de Investigación William Isacoff para el Cáncer Gastrointestinal, Becas de investigación Stand Up to Cancer Dream Team (SU05C-AACR-DT-09-2 y SU20C-AACR-DT-16-31), el premio de beca NRSA F206416 (CA32) y T007752 GMXNUMX, la Fundación Flinn, Howard Hughes Medical Institute, Ipsen/Biomeasure and Freeberg Foundation, William Isacoff Research Foundation for Gastrointestinal Cancer, Jeanne Shelby Fund for Cancer Research of Communities Foundation of Texas y Leona M. and Harry B. Helmsley Charitable Trust.
DOI: 10.1038/s41586-019-1130-6
PERIODICO
Naturaleza
AUTORES
Yu Shi, Weina Gao, Nikki K. Lytle, Peiwu Huang, Xiao Yuan, Amanda M. Dann, Maya Ridinger, Kathleen E. DelGiorno, Corina E. Antal, Gaoyang Liang, Annette R. Atkins, Galina Erikson, Huaiyu Sun, Jill Meisenhelder, Elena Terenziani, Gyunghwi Woo, Linjing Fang, Thom P. Santisakultarm, Uri Manor, Ruilian Xu, Carlos R. Becerra, Erkut Borazanci, Daniel D. Von Hoff, Paul M. Grandgenett, Michael A. Hollingsworth, Mathias Leblanc, Sarah E. Umetsu, Eric A. Collisson, Miriam Scadeng, Andrew M. Lowy, Timothy R. Donahue, Tannishtha Reya, Michael Downes, Ronald M. Evans, Geoffrey M. Wahl, Tony Pawson, Ruijun Tian y Tony Hunter
Oficina de Comunicaciones
Tel: (858) 453-4100
prensa@salk.edu
Descubrir los secretos de la vida misma es la fuerza impulsora detrás del Instituto Salk. Nuestro equipo de científicos galardonados de clase mundial traspasa los límites del conocimiento en áreas como neurociencia, investigación del cáncer, envejecimiento, inmunobiología, biología vegetal, biología computacional y más. Fundado por Jonas Salk, desarrollador de la primera vacuna contra la polio segura y eficaz, el Instituto es una organización de investigación independiente y sin fines de lucro y un hito arquitectónico: pequeño por elección, íntimo por naturaleza y valiente ante cualquier desafío.