
23 december 2010
LA JOLLA, CA - Onderzoekers van het Salk Institute for Biological Studies hebben ontdekt hoe AMPK, een metabolische hoofdschakelaar die in versnelling springt wanneer cellen bijna geen energie meer hebben, een celrecyclingprogramma op gang brengt om essentiële moleculaire bouwstenen vrij te maken in tijden van nood .
In een paper gepubliceerd in de editie van 23 december 2010 van Wetenschap Express, een team onder leiding van Ruben Shaw, PhD., Howard Hughes Medical Institute Early Career Scientist en Hearst Endowment assistent-professor in het Salk's Molecular and Cell Biology Laboratory, meldt dat AMPK een cellulair recyclingproces activeert dat bekend staat als autofagie door het activeren van een enzym, bekend als ATG1, dat het proces een vliegende start geeft.
De nieuw ontdekte directe moleculaire verbinding tussen AMPK en ATG1 is significant omdat disfuncties in zowel AMPK-signalering als autofagie betrokken zijn bij een overvloed aan verouderingsgerelateerde ziekten, waaronder diabetes type II, kanker en neurodegeneratieve ziekten zoals Parkinson en Alzheimer.
Ondanks zijn onheilspellende naam - afgeleid van "zelf" (auto) en "eten" (fagie) - gebruiken cellen autofagie om afval te verwijderen voordat het giftig genoeg wordt om een cel te doden. "Autofagie is een oud proces dat is geëvolueerd om componenten af te breken die cellen niet nodig hebben om dingen te creëren die ze wel nodig hebben", zegt Dan Egan, een afgestudeerde student in het laboratorium van Shaw en de eerste auteur van het onderzoek.
Eerder had het laboratorium van Shaw niet alleen aangetoond dat AMPK gedereguleerd is bij bepaalde vormen van kanker, maar ook dat het enzym een cruciaal doelwit is van het type 2-diabetesmedicijn metformine. "Het nemen van een medicijn dat dit pad activeert, zoals metformine, is het equivalent van het nemen van verschillende medicijnen", zegt Shaw, terwijl hij een lijst met door AMPK geactiveerde antitumor- en antidiabetesroutes afrolt. "Nu kunnen we regulering van autofagie aan die lijst toevoegen."
Het laboratorium van Shaw heeft autofagie niet eerder bestudeerd, maar is al lang geïnteresseerd in AMPK, dat detecteert wanneer de energie laag is en de celgroei vertraagt. "Aangezien AMPK zo'n centrale rol speelt bij het reguleren van de energiehuishouding van onze cellen, wilden we weten hoe het zijn macht uitoefent over zoveel cellulaire processen", zegt Shaw.
Zijn team startte de studie door een unieke targeting-sequentie te definiëren die door AMPK wordt gebruikt om zijn signalen over te brengen en vervolgens bio-informatica en biochemie te gebruiken om eiwitten te identificeren die fungeren als AMPK-doelen. Een van de hoofdverdachten die daarbij werd geïdentificeerd, was het eiwit Atg1/ULK1, een factor die autofagie in gist veroorzaakt.
Om de effecten op autofagie van het dereguleren van deze enzymen te testen, concentreerde de groep zich op grote intracellulaire structuren, mitochondria genaamd, wiens rol het is om energie op te wekken. "Mitochondria worden gemakkelijk beschadigd in ontgiftende weefsels zoals de lever", legt Shaw uit. "Een cruciale manier waarop defecte mitochondriën worden overgedragen, is via een speciale vorm van autofagie, mitofagie genaamd."
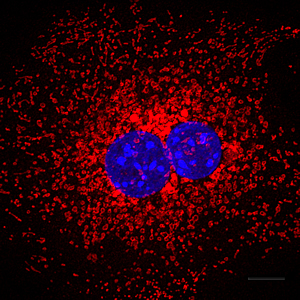
Wanneer het proces van autofagie defect is, zijn cellen niet in staat cellulaire organellen zoals mitochondriën (weergegeven in rood) te recyclen om indien nodig moleculaire bouwstenen te genereren. Celkernen weergegeven in blauw.
Afbeelding: met dank aan Daniel Egan, Salk Institute for Biological Studies
In dat geval zouden cellen hun ongezonde mitochondriën in een membraan omhullen, ze in een cellulaire zuurput dumpen en de overblijfselen recyclen. Als AMPK het proces in gang zette, zouden cellen die genetisch zijn gemanipuleerd om AMPK te missen, een veranderde mitochondriale turnover kunnen vertonen in vergelijking met normale cellen.
En dat is precies wat de onderzoekers zagen: levercellen waarin AMPK was geëlimineerd, bevatten te veel mitochondriën, waarvan er vele er spichtig uitzagen, wat erop wees dat ze stervende waren en bevestigden dat AMPK autofagische afvalverwerking aanstuurde. "We ontdekten dat het vermogen om hun defecte mitochondriën te recyclen ervoor zorgde dat cellen de hongerdood beter konden overleven", zegt Shaw.
Om het allemaal samen te binden, gebruikten de onderzoekers de rondworm C. elegans, een populair modelsysteem in verouderingsonderzoek, om aan te tonen dat geactiveerde AMPK direct autofagie activeerde via een signaal doorgegeven door de wormversie van Atg1/ULK1-experimenten uitgevoerd in samenwerking met Malene Hansen, Ph.D., van La Jolla's Sanford-Burnham Medical Research Institute en met hulp van Andy Dillin, Ph.D., van Salk's Molecular and Cell Biology Laboratory.
"De wormexperimenten laten zien dat de verbinding tussen AMPK, ULK1 en autofagie gedurende de evolutie behouden blijft en niet alleen een recente aanpassing die specifiek is voor zoogdieren", zegt Egan. "Processen die van fundamenteel belang zijn voor het leven, zoals energieregulatie, metabolisme en autofagie, delen componenten tussen mens-, muis-, worm- en gistsoorten."
Maar als je geen evolutiebioloog bent, heb je nog steeds een persoonlijk belang bij AMPK-signalering als je: regelmatig traint, je goed voelt over het drinken van rode wijn, diabetesmedicijnen neemt en/of jezelf uithongert in de hoop op een lang leven - alles die naar verluidt AMPK-signalen stimuleren.
Voeg daarbij de mogelijkheid dat AMPK antitumoractiviteit kan hebben en het is geen wonder dat farmaceutische bedrijven zeer geïnteresseerd zijn in de eiwitten waar AMPK "tegen praat" en hoe medicijnen die dat gesprek stimuleren, werken.
Ook droegen bij aan de studie: David Shackelford, Maria Mihaylova, Rebecca Kohnz, William Mair, Debbie Vasquez, Dana Gwinn en Rebecca Taylor, allemaal van het Molecular and Cell Biology Lab aan de Salk; James Fitzpatrick, van het Waitt Advanced Biophotonics Center van Salk; Sara Gelino van het Sanford-Burnham Medical Research Institute; Aashish Joshi en Mondira Kundu van het St. Jude Children's Research Hospital; John Asara van de Harvard Medical School; en Benoit Viollet van het Institut Cochin in Parijs.
Dit werk werd ondersteund door subsidies van de National Institutes of Health, de American Cancer Society, de American Diabetes Association, het Howard Hughes Medical Institute, het Burroughs Welcome Fund, de American Lebanese Syrian Association, de Agence Nationale de la Recherche, de Ellison Medical Foundation, en de Leona M. en Harry B. Helmsley Charitable Trust.
Over het Salk Instituut voor Biologische Studies:
Het Salk Institute for Biological Studies is een van 's werelds meest vooraanstaande instellingen voor fundamenteel onderzoek, waar internationaal gerenommeerde faculteiten fundamentele levenswetenschappelijke vragen onderzoeken in een unieke, collaboratieve en creatieve omgeving. Salk-wetenschappers zijn zowel gericht op ontdekking als op het begeleiden van toekomstige generaties onderzoekers en leveren baanbrekende bijdragen aan ons begrip van kanker, veroudering, Alzheimer, diabetes en infectieziekten door neurowetenschappen, genetica, cel- en plantenbiologie en aanverwante disciplines te bestuderen.
Faculteitsprestaties zijn erkend met tal van onderscheidingen, waaronder Nobelprijzen en lidmaatschappen van de National Academy of Sciences. Het instituut, opgericht in 1960 door poliovaccinpionier Jonas Salk, MD, is een onafhankelijke non-profitorganisatie en architectonisch monument.
Het Salk Institute viert met trots vijf decennia van wetenschappelijke excellentie in fundamenteel onderzoek.
Bureau voor communicatie
Tel: (858) 453-4100
pers@salk.edu