
Febrero 5, 2007
La Jolla, CA – Con una paleta de pinturas cromosómicas, los científicos del Instituto Salk de Estudios Biológicos han dado un paso más para comprender la relación entre el envejecimiento y el cáncer al visualizar los cromosomas de las células de pacientes con una enfermedad hereditaria de envejecimiento prematuro conocida como Síndrome de Werner. .
En un estudio que se publicará en la edición en línea de esta semana del procedimientos de la Academia Nacional de Ciencias investigadores dirigidos por Jan Karlseder, Ph.D., profesor asistente en el Laboratorio de Biología Reguladora de Salk, mostró que la reconstrucción de estructuras llamadas telómeros, que se encuentran en las puntas de cada cromosoma, bloquea significativamente el tipo de daño genético que se observa en las células de los pacientes con síndrome de Werner.
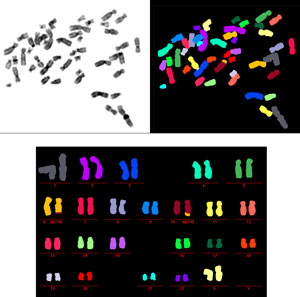
Imagen cortesía de la Dra. Anna Jauch, Instituto de Genética Humana en Heidelberg, Alemania.
Los cromosomas se aislaron de una célula extraída de un paciente con síndrome de Werner, una enfermedad de envejecimiento prematuro causada por la pérdida del gen WRN. Pintar cada par de cromosomas en un color diferente revela la ruptura y fusión de los cromosomas (ver cromosomas 6 y 10), lo que provoca inestabilidad genómica y podría explicar la alta incidencia de cáncer entre las personas con síndrome de Werner.
Los pacientes con síndrome de Werner manifiestan signos de envejecimiento, como arrugas en la piel, calvicie o canas en la adolescencia. La mayoría muere a los 40 o 50 años debido a una predisposición a enfermedades como el cáncer. “El cáncer casi siempre está relacionado con la inestabilidad cromosómica”, explica Karlseder. “Si se pierden telómeros en cromosomas individuales, entonces los cromosomas no están protegidos y pueden fusionarse con otros cromosomas no protegidos. Luego, cuando las células se dividen, los cromosomas se rompen al azar, lo que lleva a la inestabilidad del genoma”.
El estudio actual amplió el trabajo publicado en 2004 por Karlseder y la primera autora Laure Crabbe, Ph.D., quien era estudiante de posgrado en el laboratorio de Karlseder en ese momento. En ese trabajo, el equipo usó una técnica llamada FISH, abreviatura de fluorescente in situ hhibridación: para visualizar microscópicamente tanto los telómeros como el ADN cromosómico de los pacientes con síndrome de Werner. Informaron que en realidad faltaban algunos telómeros protectores en los cromosomas de los pacientes, un hallazgo que Karlseder describe como "un evento bastante catastrófico para una célula".
Para el estudio actual, los investigadores de Salk cultivaron células de pacientes con síndrome de Werner en placas de cultivo de tejidos y, con la ayuda de colegas del Instituto de Genética Humana en Heidelberg, Alemania, evaluaron el daño en el ADN utilizando una variación muy colorida de la técnica FISH llamada pintura cromosómica. Esta técnica “pinta” o etiqueta cada par de los 46 cromosomas con un tinte fluorescente de diferente color, lo que permite a los investigadores ver fácilmente la rotura o fusión de los cromosomas que son característicos del ADN dañado bajo el microscopio.
Luego, suministraron artificialmente a las células cultivadas uno de dos genes: una copia funcional del WRN gen, que es mutante o no funcional en el síndrome de Werner, o un gen que codifica la proteína telomerasa, que alarga los telómeros cortos o faltantes. Después de que las células se dividieran varias veces, se volvió a examinar su ADN para determinar el tipo de daño asociado tanto con el envejecimiento como con el cáncer.
Células provistas de un funcional WRN El gen mostró una disminución del daño en el ADN en comparación con las células no tratadas, lo cual era predecible: el WRN El gen codifica una proteína llamada helicasa que desenrolla hebras de ADN estrechamente enrolladas cuando las células se dividen. La pérdida de proteína WRN en individuos con síndrome de Werner es responsable de la enfermedad. Crabbe, ahora becario postdoctoral en el Instituto de Genética Humana en Montpellier, Francia, explica: "La falta de una sola proteína (WRN) indujo la pérdida de algunos telómeros, lo que llevó a una detención prematura del crecimiento celular".
Sin embargo, el hallazgo más interesante fue lo que los científicos observaron en las células a las que se les añadió telomerasa. “Cuando colocamos telomerasa en las células, suprimimos la acumulación de mutaciones en el mismo grado que cuando volvimos a colocar la proteína WRN”, informa Karlseder. “Reparó el defecto al alargar los telómeros cortos que se ven en las células del síndrome de Werner”.
Crabbe, que continúa estudiando la replicación del ADN como postdoctorado, concluye que estos hallazgos no solo proporcionan un mecanismo subyacente al envejecimiento acelerado observado en el síndrome de Werner, sino que también establecen un vínculo con la predisposición al cáncer y dice: "Estos resultados indican que la disfunción de los telómeros en el síndrome de Werner células es una de las principales causas de la inestabilidad genómica y podría explicar la alta incidencia de cáncer que se observa en esta enfermedad”.
Traducir estos hallazgos en un tratamiento para el síndrome de Werner será extremadamente difícil. Sin embargo, Karlseder se siente optimista sobre lo que muestran estas investigaciones. “Estudiamos esta enfermedad porque es un excelente modelo para el envejecimiento, y aquí mostramos una relación directa entre el envejecimiento, la pérdida de telómeros y la aparición de cáncer”, dice. “Predigo que el cáncer en las personas mayores tiene precisamente la misma base que el observado en los pacientes con síndrome de Werner. Es por eso que este fue un estudio tan satisfactorio”.
También contribuyeron a este estudio la estudiante de posgrado Colleen Naeger en el laboratorio de Karlseder y Anna Jauch, Ph.D., y Heidi Holgreve-Grez, Ph.D., en Heidelberg.
El Instituto Salk de Estudios Biológicos en La Jolla, California, es una organización independiente sin fines de lucro dedicada a los descubrimientos fundamentales en las ciencias de la vida, la mejora de la salud humana y la capacitación de futuras generaciones de investigadores. Jonas Salk, MD, cuya vacuna contra la poliomielitis casi erradicó la poliomielitis, una enfermedad paralizante en 1955, inauguró el Instituto en 1965 con un terreno donado por la ciudad de San Diego y el apoyo financiero de March of Dimes.
Oficina de Comunicaciones
Tel: (858) 453-4100
prensa@salk.edu