
12 de mayo de 2011
Los inhibidores de HDAC pueden proporcionar una forma novedosa de reducir los niveles excesivos de glucosa en sangre en la fuente
Los inhibidores de HDAC pueden proporcionar una forma novedosa de reducir los niveles excesivos de glucosa en sangre en la fuente
LA JOLLA, CA—Un estudio de colaboración único realizado por investigadores del Instituto Salk de Estudios Biológicos descubrió un mecanismo novedoso que aumenta la producción de glucosa en el hígado cuando los niveles de azúcar en la sangre caen, apuntando hacia una nueva clase de medicamentos para el tratamiento de enfermedades metabólicas.
Sus hallazgos, publicados en la edición del 13 de mayo de 2011 de la revista Celular, reveló un papel crucial para las llamadas histonas desacetilasas (HDAC), un grupo de enzimas que es el objetivo de la última generación de medicamentos contra el cáncer. Los HDAC activan la producción de azúcar cuando los niveles de glucosa en sangre bajan después de períodos prolongados de ayuno o durante la noche.
"En las células hepáticas, las HDAC de clase II generalmente se secuestran fuera del núcleo, pero en respuesta a las señales de ayuno, se trasladan rápidamente al núcleo, donde ayudan a activar los genes necesarios para la producción de glucosa", dice el científico de carrera temprana del Instituto Médico Howard Hughes. Rubén J. Shaw, Ph.D., profesor asistente en el Laboratorio de Biología Molecular y Celular. “Por lo tanto, los medicamentos que inhiben específicamente las HDAC involucradas en la gluconeogénesis pueden ser muy útiles para el tratamiento de la diabetes y el síndrome metabólico”.
Un equilibrio delicado y estrictamente regulado entre novo la producción de glucosa en el hígado y el almacenamiento en caché del exceso de glucosa en los músculos y el tejido adiposo evitan que los niveles de azúcar en la sangre fluctúen de manera errática y causen daños irreparables a las células y tejidos del cuerpo.
Después de una comida, la insulina instruye a las células musculares para que almacenen la glucosa para su uso posterior y apaga la producción de azúcar en el hígado, lo que garantiza que los niveles de azúcar en la sangre no aumenten demasiado. Por el contrario, la hormona del ayuno, el glucagón, indica a las células hepáticas que activen la producción de glucosa cuando los suministros se agotan.
Sin embargo, en muchos pacientes con diabetes tipo II, el cuerpo hace oídos sordos al mensaje urgente de la insulina y, como resultado, el hígado actúa como una fábrica de azúcar en horas extras, produciendo glucosa durante todo el día, incluso cuando los niveles de azúcar en la sangre son altos. Actualmente, el fármaco más utilizado para controlar los niveles de glucosa en sangre en diabéticos tipo II es la metformina.
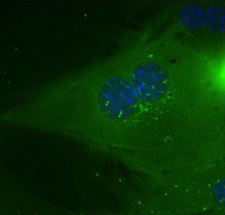
En las células hepáticas, las denominadas HDAC de clase II (que se muestran en verde) suelen estar secuestradas en el núcleo.
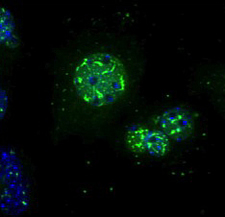
En respuesta al glucagón, las HDAC se trasladan rápidamente al núcleo, donde ayudan a activar los genes necesarios para la producción de glucosa en el hígado.
Imágenes: Cortesía de Maria Mihaylova, Instituto Salk de Estudios Biológicos.
"La metformina se deriva originalmente de una planta que se encuentra en Europa occidental llamada 'lila francesa' o 'Ruda de la cabra' porque a las cabras no les gustaba comerla", dice Shaw. “Se mantuvieron alejados de la planta porque contiene un compuesto que actúa para reducir naturalmente la glucosa en sangre en los animales que la comen, para evitar que la vuelvan a comer”.
Hace unos años, Shaw había descubierto cómo la metformina ayuda a la insulina a controlar los niveles de glucosa. Se une a un "interruptor maestro metabólico" conocido como AMPK que bloquea la producción de glucosa en el hígado. Al tratar de identificar nuevos objetivos de AMPK que podrían ser relevantes para la diabetes, Maria Mihaylova, estudiante de posgrado en el laboratorio de Shaw, centró sus esfuerzos en una familia de HDAC conocidas como HDAC de clase II. Funcionan como reguladores negativos de la actividad génica al estabilizar la estructura estrechamente enrollada del ADN en los cromosomas, haciéndola inaccesible a las proteínas que transcriben el ADN.
"Identificamos las HDAC de clase II como objetivos directos de AMPK en una pantalla basada en bioinformática, pero no sabíamos qué genes podrían regular en el hígado, ya que ni siquiera se sabía que se encontraran allí", dice Mihaylova. En estrecha colaboración con el investigador del Instituto Médico Howard Hughes, Ronald M. Evans, profesor del Laboratorio de Expresión Génica del Instituto Salk, y su equipo, Mihaylova descubrió que la inhibición de las HDAC de clase II desactiva los genes que codifican las enzimas necesarias para sintetizar glucosa en el hígado.
En colaboración con sus colegas en el laboratorio de Marc Montminy, profesor de Clayton Laboratories for Peptide Biology y, al igual que Shaw y Evans, miembro del Centro de Genómica Nutricional del Instituto Salk, Mihaylova descubrió que las propias HDAC se asociaban con los elementos reguladores del ADN que controlan la expresión de las enzimas sintetizadoras de glucosa, pero solo acudieron allí después de haber tratado las células con la hormona glucagón en ayunas.
“En respuesta al glucagón, se eliminan las modificaciones químicas en las HDAC de clase II y pueden trasladarse al núcleo”, explica. Allí, se unen a FOXO, un regulador metabólico clave, que se había demostrado previamente que la insulina lo desactiva.
“Fue una gran sorpresa que FOXO se active con glucagón”, explica Shaw. Otros experimentos confirmaron que la supresión genética de las HDAC de clase II en las células hepáticas condujo a un aumento de FOXO acetilado, que ahora no puede unirse al ADN ni activar los genes que codifican las enzimas sintetizadoras de glucosa.
Un estudio paralelo, dirigido por Montminy y publicado en la misma edición de Cell que el artículo de Shaw, muestra que en las moscas de la fruta, FOXO no solo controla la expresión de una enzima que digiere grasas, sino que también es activado por una hormona similar al glucagón de manera similar. al humano FOXO. "El circuito central de cómo los animales regulan el metabolismo en respuesta al ayuno y la alimentación se conserva desde la mosca hasta el hombre, lo que enfatiza la importancia de las HDAC de clase II en la coordinación de cómo las diferentes hormonas dirigen la creación y el uso de la glucosa", dice Shaw, quien es coautor del artículo de Montminy.
Hasta este momento, todos los experimentos se habían realizado en células cultivadas, pero Shaw y su equipo estaban realmente interesados en saber si las HDAC de clase II controlaban la glucosa en sangre en modelos de diabetes en ratones. Sorprendentemente, la supresión de las tres HDAC restauró simultáneamente los niveles de glucosa en sangre a casi lo normal en cuatro modelos diferentes de diabetes tipo 2.
“Estos emocionantes resultados muestran que los medicamentos que inhiben la actividad de las HDAC de clase II pueden valer la pena como posibles medicamentos para la diabetes”, dice Shaw. Recientemente, muchas compañías farmacéuticas han estado desarrollando inhibidores de HDAC como medicamentos contra el cáncer, por lo que Shaw especula que algunos de estos compuestos, que pueden o no ser útiles para el cáncer, podrían tener potencial terapéutico para el tratamiento de la resistencia a la insulina y la diabetes.
"La clave será bloquear específicamente las HDAC involucradas en el control de la glucosa", dice, "pero el hecho de que la gluconeogénesis tenga lugar en el hígado facilita esta tarea, ya que la mayoría de los medicamentos tarde o temprano viajan al hígado una vez que llegan al torrente sanguíneo". A continuación, Shaw planea probar si estos HDAC amantes de la glucosa también pueden desempeñar un papel en ciertas formas de cáncer.
Los investigadores que también contribuyeron al trabajo incluyen a Debbie S. Vasquez y Pierre-Damien Denechaud en el Molecular and Cell Biology Laboratory, Kim Ravnskjaer en Clayton Laboratories for Peptide Biology, Ruth T. Yu, Jacqueline G. Alvarez y Michael Downes en Gene Laboratorio de Expresión.
Este trabajo fue apoyado por subvenciones de los Institutos Nacionales de Salud, la Asociación Estadounidense de Diabetes, el Instituto Médico Howard Hughes, y un apoyo significativo para este estudio provino de The Leona M. and Harry B. Helmsley Charitable Trust.
El Centro de Genómica Nutricional se estableció en 2008 con una subvención de The Leona M. and Harry B. Helmsley Charitable Trust para estudiar específicamente los mecanismos fundamentales que subyacen al desarrollo y tratamiento de la diabetes y las enfermedades metabólicas.
Sobre el Instituto Salk de Estudios Biológicos:
El Instituto Salk de Estudios Biológicos es una de las instituciones de investigación básica más importantes del mundo, donde profesores de renombre internacional investigan cuestiones fundamentales de las ciencias de la vida en un entorno único, colaborativo y creativo. Centrados tanto en el descubrimiento como en la orientación de futuras generaciones de investigadores, los científicos de Salk realizan contribuciones innovadoras a nuestra comprensión del cáncer, el envejecimiento, el Alzheimer, la diabetes y las enfermedades infecciosas mediante el estudio de la neurociencia, la genética, la biología celular y vegetal y disciplinas relacionadas.
Los logros de la facultad han sido reconocidos con numerosos honores, incluidos premios Nobel y membresías en la Academia Nacional de Ciencias. Fundado en 1960 por el pionero de la vacuna contra la polio Jonas Salk, MD, el Instituto es una organización independiente sin fines de lucro y un hito arquitectónico.
Oficina de Comunicaciones
Tel: (858) 453-4100
prensa@salk.edu