
25 de agosto de 2010
LA JOLLA, CA—Un mecanismo novedoso utilizado por el adenovirus para eludir el programa suicida de la célula podría contribuir en gran medida a explicar cómo se silencian los genes supresores de tumores en las células tumorales y allana el camino para un nuevo tipo de terapia dirigida contra el cáncer, informan investigadores de Salk Institute for Biological Studies en la edición del 26 de agosto de 2010 de Naturaleza.
Cuando una célula está bajo estrés, el supresor de tumores p53 entra en acción activando un ejército de soldados de infantería que inician un mecanismo de "autodestrucción" incorporado que elimina del cuerpo las células infectadas por virus o anormales. Al igual que las células tumorales, los adenovirus, que causan infecciones de las vías respiratorias superiores, necesitan eliminar la p53 para multiplicarse con éxito.
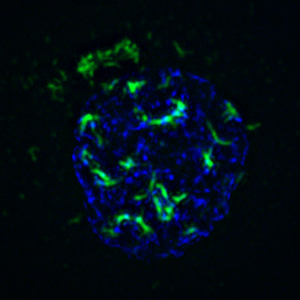
La pequeña proteína de adenovirus conocida como ORF3 (que se muestra en verde) despeja el camino para la replicación de adenovirus al crear "archivos comprimidos" de genes que ayudan a la célula a defenderse contra el virus. O'Shea espera explotar este hallazgo para crear adenovirus que destruyan selectivamente las células cancerosas.
Imagen: Cortesía del Dr. Clodagh O'Shea, Instituto Salk de Estudios Biológicos
"En lugar de inactivar p53 directamente, el adenovirus hace que el 'guardián del genoma' sea impotente al atacar el propio genoma", explica Clodagh O'Shea, Ph.D., profesor asistente en el Laboratorio de Biología Molecular y Celular, quien dirigió el estudio. "Literalmente crea archivos zip de genes diana p53 comprimiéndolos hasta que ya no se pueden leer".
La vía supresora de tumores p53 está inactiva en casi todos los cánceres humanos, lo que permite que las células escapen a los controles de crecimiento normales. Sin embargo, todavía no existe una terapia dirigida contra el cáncer racionalmente diseñada para tratar a los pacientes en función de la pérdida de p53.
“Todas las terapias dirigidas que tenemos se basan en moléculas pequeñas que inactivan oncogenes, pero el cáncer no es causado únicamente por la ganancia de genes que promueven el crecimiento”, dice O'Shea. “La pérdida de supresores de tumores es igual de importante. La gran pregunta es ¿cómo apuntas a algo que ya no está?
El adenovirus parecía proporcionar la respuesta. Trae consigo una proteína viral, E1B-55K, que se une y degrada p53 en las células infectadas. Sin E1B-55K para inactivar p53, el adenovirus solo debería poder replicarse en células tumorales deficientes en p53. Luego, cada vez que abre la célula huésped para liberar miles de progenies virales, la próxima generación de virus está lista para buscar las células cancerosas restantes mientras deja intactas las células normales.
“Esto convierte al adenovirus en un candidato perfecto para la terapia del cáncer oncolítico”, dice O'Shea. “Aunque estos virus hicieron su trabajo, para sorpresa de todos, las respuestas de los pacientes no se correlacionaron con el estado de p53 de sus tumores”, dice O'Shea. Intrigados, ella y su equipo dieron seguimiento a este hallazgo inesperado.
Conrado Soria, Ph.D., asistente de investigación y coautor del estudio, se dio cuenta rápidamente de que E1B-55K era solo la mitad de la historia. “La incapacidad del virus mutante E1B-55K para replicarse en células normales no se debió a que el virus no degradara p53”, explica.
En células normales no estresadas, p53 solo se encuentra en niveles bajos debido a la rápida degradación. En respuesta al daño del ADN, la activación de oncogenes o la infección por virus de ADN, se detiene la degradación de p53 y, como resultado, se acumulan los niveles de proteína de p53. Este aumento activa los genes diana p53, que detienen el ciclo celular o inducen la apoptosis.
Tal como se predijo, p53 comenzó a acumularse en células normales que habían sido infectadas con adenovirus que carecían de E1B-55K, pero aún no podía activar sus genes diana e iniciar la célula en el camino hacia la apoptosis. Eventualmente descubrió por qué: el adenovirus trae otra proteína, E4-ORF3, que neutraliza el punto de control p53 a través de un mecanismo completamente diferente.
En lugar de inactivar p53 directamente, la diminuta proteína evita que el supresor tumoral se una a sus genes diana en el genoma modificando la cromatina, el denso complejo histona/ADN que mantiene todo perfectamente organizado dentro del núcleo de las células. "Estas modificaciones hacen que partes de los cromosomas se condensen en la llamada heterocromatina, enterrando las regiones reguladoras de los genes diana p53 en lo más profundo", dice la estudiante graduada y coautora Fanny E. Estermann. "Con el acceso denegado, p53 es impotente para apretar el gatillo de la apoptosis".
O'Shea espera explotar estos nuevos conocimientos para comprender cómo se pueden inactivar los altos niveles de p53 de tipo salvaje en el cáncer, así como los mecanismos que inducen el silenciamiento aberrante de los loci del gen supresor de tumores en las células cancerosas. "Nuestro estudio realmente cambia la definición de larga data de cómo se inactiva p53 en las células infectadas con adenovirus y finalmente nos permitirá desarrollar verdaderas terapias oncolíticas selectivas de tumores p53".
El trabajo fue financiado en parte por la Alianza de Terapia Génica del Cáncer, la Sociedad Americana del Cáncer, la Fundación Sontag, la Fundación Beckman y el Instituto Nacional del Cáncer.
Acerca del Instituto Salk de Estudios Biológicos
El Instituto Salk de Estudios Biológicos es una de las instituciones de investigación básica más importantes del mundo, donde profesores de renombre internacional investigan cuestiones fundamentales de las ciencias de la vida en un entorno único, colaborativo y creativo. Centrados tanto en el descubrimiento como en la orientación de futuras generaciones de investigadores, los científicos de Salk realizan contribuciones innovadoras a nuestra comprensión del cáncer, el envejecimiento, el Alzheimer, la diabetes y las enfermedades infecciosas mediante el estudio de la neurociencia, la genética, la biología celular y vegetal y disciplinas relacionadas.
Los logros de la facultad han sido reconocidos con numerosos honores, incluidos premios Nobel y membresías en la Academia Nacional de Ciencias. Fundado en 1960 por el pionero de la vacuna contra la polio Jonas Salk, MD, el Instituto es una organización independiente sin fines de lucro y un hito arquitectónico.
El Instituto Salk celebra con orgullo cinco décadas de excelencia científica en investigación básica.
Oficina de Comunicaciones
Tel: (858) 453-4100
prensa@salk.edu