
9 de agosto de 2009
LA JOLLA, CA—Un estudio colaborativo realizado por investigadores del Salk Institute for Biological Studies descubrió que el supresor de tumores p53, que se ganó su nombre como "guardián del genoma", no solo detiene las células que podrían volverse cancerosas en su camino, sino que también controla reprogramación de células somáticas.
Aunque los científicos han aprendido a reprogramar células humanas adultas, como las células de la piel, en las llamadas células madre pluripotentes inducidas (iPSC), la eficiencia de la reprogramación sigue siendo lamentablemente baja. El estudio de Salk, publicado en la edición avanzada en línea del 9 de agosto de Naturaleza, da una nueva perspectiva de por qué solo unas pocas células de muchas pueden ser persuadidas para hacer retroceder el reloj.

Dr. Juan-Carlos Izpisúa Belmonte y Dr. Geoffrey M. Wahl
"Aunque hemos podido reprogramar células especializadas desde hace un tiempo, no se sabía nada sobre los mecanismos de control que evitan que suceda espontáneamente en el cuerpo y por qué ha sido tan difícil cambiar su destino en una placa de Petri". dice Juan Carlos Izpisúa Belmonte, Ph.D., profesor en el Laboratorio de Expresión Génica, quien trabajó de cerca con Geoffrey M. Wahl, Ph.D., también profesor en el Laboratorio de Expresión Génica.
Sus hallazgos acercan la tecnología iPSCs a cumplir su promesa como fuente de células madre específicas para pacientes, pero también obligan a los científicos a repensar el desarrollo del cáncer.
“Ha existido una idea de hace una década de que el cáncer surge a través de la desdiferenciación de células especializadas y completamente comprometidas, pero finalmente se descartó en favor de la teoría de las células madre del cáncer actualmente de moda”, dice Wahl. “Ahora que sabemos que p53 previene la desdiferenciación, creo que es hora de reconsiderar la posibilidad de que la reprogramación desempeñe un papel en el desarrollo del cáncer, ya que prácticamente todas las células cancerosas pierden la función de p53 de una forma u otra”.
A medida que los embriones de mamíferos pasan por una serie de etapas de desarrollo, las opciones de células madre embrionarias, que disfrutan de perspectivas casi ilimitadas, se limitan progresivamente hasta que finalmente dan lugar a los aproximadamente 200 tipos de células que componen nuestro cuerpo y, en general, carecen de la capacidad de revertir volver a una etapa menos especializada.
Aunque la diferenciación es generalmente irreversible, los científicos han desarrollado varios métodos para superar la renuencia de las células a ser reprogramadas. La tecnología más utilizada implica la expresión forzada de cuatro factores de transcripción (Oct4, Sox2, Klf4 y c-Myc) en células adultas totalmente comprometidas.
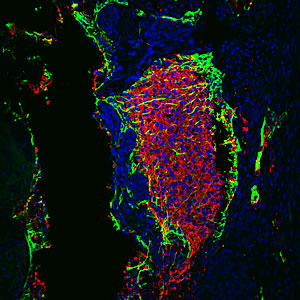
La regulación a la baja de la actividad de p53 aumenta la eficiencia de reprogramación de las células somáticas adultas que requieren solo dos factores de reprogramación en lugar de los cuatro habituales.
Imagen: Cortesía del Dr. Juan-Carlos Belmonte, Instituto Salk de Estudios Biológicos
“Desafortunadamente, Klf4 y c-Myc son oncogenes y agregarlos conlleva el riesgo de inducir cáncer”, dice Belmonte. Sin embargo, a pesar del impulso adicional proporcionado por esos poderosos oncogenes, solo una pequeña fracción se transforma en iPSC que se ven y actúan como células madre embrionarias, lo que lleva a Belmonte a preguntarse si lo que estaban haciendo para que las células se reprogramaran indujo una respuesta que detuvo las células. de crecer?
Una conversación con su vecino de al lado, el experto en cáncer Wahl, proporcionó algunas ideas nuevas que podrían probarse en el laboratorio. “Normalmente, las células no se reprograman, por lo que debe haber un mecanismo que lo impida”, dice Wahl. "Sabíamos que c-Myc y algunos de los otros genes que se requieren para la reprogramación activan el supresor de tumores p53 y nos preguntamos si tenía algo que ver".
Y, efectivamente, los experimentos de los investigadores postdoctorales y coautores Teruhisa Kawamura, Ph.D., y Jotaro Suzuki, Ph.D., revelaron que agregar los factores de reprogramación c-Myc y Klf4, solos o en varias combinaciones, activaron el p53 ruta. Como primer respondedor, el supresor de tumores p53 entra en acción cuando las células experimentan condiciones estresantes. Dependiendo de la situación, p53 luego activa los genes que detienen la división celular para dar tiempo a las reparaciones o, cuando todos los intentos de rescate resultan inútiles, ordenan a la célula que deje de dividirse para siempre o que se suicide.
En las células modificadas genéticamente para carecer de p53, la eficiencia de reprogramación aumentó al menos 10 veces en comparación con las células de control, lo que demuestra que p53 jugó claramente un papel importante en el reinado de las células que intentan volver a un estado similar al de un tallo.
Debido a que las iPSC generadas con el complemento completo de factores de reprogramación corren el riesgo de volverse malignas, Belmonte y su equipo querían saber si las células de ratón que carecen de p53 podrían reprogramarse usando solo dos factores, Oct4 y Sox2. Las células se convirtieron fácilmente en iPSC y dieron lugar a ratones sanos a término que pudieron reproducirse y superar la prueba definitiva de células madre embrionarias pluripotentes.
“Esta exitosa colaboración es un excelente ejemplo de lo que hace que Salk sea un lugar tan especial”, dice Wahl. “Juan Carlos y yo hablamos todos los días y abordamos la misma cuestión desde perspectivas muy diferentes. Él viene desde la perspectiva de la biología del desarrollo, mientras que yo vengo del lado del cáncer, pero cuando se juntan pueden formar una gran historia”.
Para obtener información sobre la comercialización de esta tecnología, comuníquese con la Oficina de Gestión y Desarrollo de Tecnología de Salk al (858) 453-4100, ext. 1278.
Este trabajo fue apoyado por los Institutos Nacionales de Salud, subvenciones de Tercel, Marato, G. Harold and Leila Y. Mathers Charitable Foundation y la Fundación Cellex.
Los investigadores que también contribuyeron al trabajo incluyen a Yunyuan V. Wang, Ph.D. en el laboratorio de Wahl, Sergio Menendez, Ph.D., Laura Batlle Morera, Ph.D., y Angel Raya, Ph.D., todos en el Centro de Medicina Regenerativa de Barcelona, España.
Sobre el Instituto Salk de Estudios Biológicos:
El Instituto Salk de Estudios Biológicos es una de las instituciones de investigación básica más importantes del mundo, donde profesores de renombre internacional investigan cuestiones fundamentales de las ciencias de la vida en un entorno único, colaborativo y creativo. Centrados tanto en el descubrimiento como en la orientación de futuras generaciones de investigadores, los científicos de Salk realizan contribuciones innovadoras a nuestra comprensión del cáncer, el envejecimiento, el Alzheimer, la diabetes y los trastornos cardiovasculares mediante el estudio de la neurociencia, la genética, la biología celular y vegetal y disciplinas relacionadas.
Los logros de la facultad han sido reconocidos con numerosos honores, incluidos premios Nobel y membresías en la Academia Nacional de Ciencias. Fundado en 1960 por el pionero de la vacuna contra la polio Jonas Salk, MD, el Instituto es una organización independiente sin fines de lucro y un hito arquitectónico.
Oficina de Comunicaciones
Tel: (858) 453-4100
prensa@salk.edu