
23 de diciembre de 2010
LA JOLLA, CA—Investigadores del Salk Institute for Biological Studies han descubierto cómo AMPK, un interruptor maestro metabólico que se activa cuando las células se quedan sin energía, acelera un programa de reciclaje celular para liberar bloques de construcción moleculares esenciales en tiempos de necesidad .
En un artículo publicado en la edición del 23 de diciembre de 2010 de Expreso de la ciencia, equipo dirigido por Rubén Shaw, PhD., científico de carrera temprana del Instituto Médico Howard Hughes y profesor asistente de Hearst Endowment en el Laboratorio de Biología Molecular y Celular de Salk, informa que AMPK activa un proceso de reciclaje celular conocido como autofagia mediante la activación de una enzima, conocida como ATG1, que inicia el proceso.
La conexión molecular directa recién descubierta entre AMPK y ATG1 es significativa porque las disfunciones tanto en la señalización de AMPK como en la autofagia están implicadas en una gran cantidad de enfermedades relacionadas con el envejecimiento, incluida la diabetes tipo II, el cáncer y enfermedades neurodegenerativas como el Parkinson y el Alzheimer.
A pesar de su ominoso nombre, derivado de "yo" (auto) y "comer" (fagia), las células usan la autofagia para deshacerse de los desechos antes de que se vuelvan lo suficientemente tóxicos como para matar una célula. "La autofagia es un proceso antiguo que evolucionó para descomponer los componentes que las células no necesitan para crear cosas que sí necesitan", dice Dan Egan, estudiante graduado en el laboratorio de Shaw y primer autor del estudio.
Previamente, el laboratorio de Shaw no solo había demostrado que la AMPK está desregulada en ciertas formas de cáncer, sino también que la enzima es un objetivo crítico del medicamento para la diabetes tipo 2, la metformina. “Tomar un medicamento que active esta vía, como la metformina, es el equivalente a tomar varios medicamentos diferentes”, dice Shaw, recitando una lista de vías antitumorales y antidiabéticas activadas por AMPK. “Ahora podemos agregar la regulación de la autofagia a esa lista”.
El laboratorio de Shaw no ha estudiado previamente la autofagia, pero ha tenido un interés a largo plazo en AMPK, que detecta cuando la energía es baja y ralentiza el crecimiento celular. "Dado que AMPK juega un papel tan central en la regulación del hogar energético de nuestras células, queríamos saber cómo ejerce su poder sobre tantos procesos celulares", dice Shaw.
Su equipo inició el estudio definiendo una secuencia de orientación única utilizada por AMPK para transmitir sus señales y luego usando bioinformática y bioquímica para identificar proteínas que actúan como objetivos de AMPK. Uno de los principales sospechosos identificados en ese esfuerzo fue la proteína Atg1/ULK1, un factor que desencadena la autofagia en la levadura.
Para probar los efectos sobre la autofagia de la desregulación de estas enzimas, el grupo se centró en grandes estructuras intracelulares llamadas mitocondrias, cuya función es generar energía. “Las mitocondrias se dañan fácilmente al desintoxicar tejidos como el hígado”, explica Shaw. "Una forma crítica en que las mitocondrias defectuosas se renuevan es a través de una forma especial de autofagia llamada mitofagia".
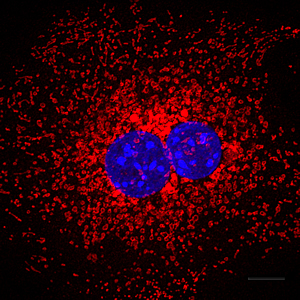
Cuando el proceso de autofagia es defectuoso, las células no pueden reciclar los orgánulos celulares como las mitocondrias (que se muestran en rojo) para generar bloques de construcción moleculares cuando sea necesario. Los núcleos celulares se muestran en azul.
Imagen: Cortesía de Daniel Egan, Instituto Salk de Estudios Biológicos
En ese caso, las células envolverían sus mitocondrias enfermas en una membrana, las verterían en un pozo de ácido celular y reciclarían los restos. Si AMPK iniciara el proceso, las células diseñadas genéticamente para carecer de AMPK podrían mostrar un recambio mitocondrial alterado en comparación con las células normales.
Y eso es precisamente lo que vieron los investigadores: las células hepáticas en las que se había eliminado la AMPK contenían demasiadas mitocondrias, muchas de las cuales parecían delgadas, lo que indicaba que estaban moribundas y confirmaba que la AMPK dirigía la eliminación de desechos autofágicos. "Descubrimos que la capacidad de reciclar sus mitocondrias defectuosas permitía que las células sobrevivieran mejor al hambre", dice Shaw.
Para unirlo todo, los investigadores usaron el gusano redondo C. elegans, un sistema modelo popular en la investigación del envejecimiento, para demostrar que la AMPK activada activó directamente la autofagia a través de una señal transmitida por la versión del gusano de Atg1/ULK1: experimentos realizados en colaboración con Malene Hansen, Ph.D., de Sanford-Burnham Medical de La Jolla. Research Institute y con la ayuda de Andy Dillin, Ph.D., del Laboratorio de Biología Celular y Molecular de Salk.
“Los experimentos con gusanos muestran que la conexión entre AMPK, ULK1 y la autofagia se conserva a lo largo de la evolución y no solo una adaptación reciente específica de los mamíferos”, dice Egan. "Los procesos fundamentales para la vida, como la regulación de la energía, el metabolismo y la autofagia, comparten componentes entre las especies de humanos, ratones, gusanos y levaduras".
Pero si no es un biólogo evolutivo, todavía tiene un interés personal en la señalización de AMPK si: hace ejercicio regularmente, se siente bien bebiendo vino tinto, toma medicamentos para la diabetes y/o se muere de hambre con la esperanza de una vida larga, todo eso que supuestamente estimulan las señales de AMPK.
Agregue a eso la posibilidad de que AMPK pueda tener actividad antitumoral y no es de extrañar que las compañías farmacéuticas estén muy interesadas en con qué proteínas "habla" AMPK y cómo funcionan los medicamentos que estimulan esa conversación.
También contribuyeron al estudio: David Shackelford, Maria Mihaylova, Rebecca Kohnz, William Mair, Debbie Vasquez, Dana Gwinn y Rebecca Taylor, todos del Laboratorio de Biología Molecular y Celular en Salk; James Fitzpatrick, del Centro de Biofotónica Avanzada Waitt de Salk; Sara Gelino del Instituto de Investigación Médica Sanford-Burnham; Aashish Joshi y Mondira Kundu del St. Jude Children's Research Hospital; John Asara de la Facultad de Medicina de Harvard; y Benoit Viollet del Institut Cochin de París.
Este trabajo fue apoyado por subvenciones de los Institutos Nacionales de Salud, la Sociedad Estadounidense del Cáncer, la Asociación Estadounidense de Diabetes, el Instituto Médico Howard Hughes, el Fondo de Bienvenida Burroughs, la Asociación Siria Libanesa Estadounidense, la Agence Nationale de la Recherche, el Ellison Medical Foundation, y Leona M. y Harry B. Helmsley Charitable Trust.
Sobre el Instituto Salk de Estudios Biológicos:
El Instituto Salk de Estudios Biológicos es una de las instituciones de investigación básica más importantes del mundo, donde profesores de renombre internacional investigan cuestiones fundamentales de las ciencias de la vida en un entorno único, colaborativo y creativo. Centrados tanto en el descubrimiento como en la orientación de futuras generaciones de investigadores, los científicos de Salk realizan contribuciones innovadoras a nuestra comprensión del cáncer, el envejecimiento, el Alzheimer, la diabetes y las enfermedades infecciosas mediante el estudio de la neurociencia, la genética, la biología celular y vegetal y disciplinas relacionadas.
Los logros de la facultad han sido reconocidos con numerosos honores, incluidos premios Nobel y membresías en la Academia Nacional de Ciencias. Fundado en 1960 por el pionero de la vacuna contra la polio Jonas Salk, MD, el Instituto es una organización independiente sin fines de lucro y un hito arquitectónico.
El Instituto Salk celebra con orgullo cinco décadas de excelencia científica en investigación básica.
Oficina de Comunicaciones
Tel: (858) 453-4100
prensa@salk.edu