
4 de Julio de 2013
Los hallazgos de Salk descubren cambios dinámicos en el epigenoma que ocurren durante la formación de circuitos cerebrales
Los hallazgos de Salk descubren cambios dinámicos en el epigenoma que ocurren durante la formación de circuitos cerebrales
LA JOLLA, CA—Los cambios en el epigenoma, incluidas las modificaciones químicas del ADN, pueden actuar como una capa adicional de información en el genoma y se cree que desempeñan un papel en el aprendizaje y la memoria, así como en el deterioro cognitivo relacionado con la edad. Los resultados de un nuevo estudio realizado por científicos del Instituto Salk de Estudios Biológicos muestran que el panorama de la metilación del ADN, un tipo particular de modificación epigenómica, es altamente dinámico en las células cerebrales durante la transición del nacimiento a la edad adulta, lo que ayuda a comprender cómo la información en los genomas de las células en el cerebro se controlan desde el desarrollo fetal hasta la edad adulta. El cerebro es mucho más complejo que todos los demás órganos del cuerpo y este descubrimiento abre la puerta a una comprensión más profunda de cómo se forman los intrincados patrones de conectividad en el cerebro.
"Estos resultados amplían nuestro conocimiento sobre el papel único de la metilación del ADN en el desarrollo y la función del cerebro", dice el autor principal. José R. Ecker, profesor y director de Salk's Laboratorio de Análisis Genómico y titular de la Cátedra Salk International Council en Genética. "Ofrecen un nuevo marco para probar el papel del epigenoma en la función saludable y en las interrupciones patológicas de los circuitos neuronales".

Desde la izquierda: Marga Behrens, Eran Mukamel, Terry Sejnowski, Joseph Ecker
Imagen: Cortesía del Instituto Salk de Estudios Biológicos
Un cerebro sano es el producto de un largo proceso de desarrollo. La parte más frontal de nuestro cerebro, llamada corteza frontal, juega un papel clave en nuestra capacidad de pensar, decidir y actuar. El cerebro logra todo esto a través de la interacción de células especiales como las neuronas y la glía. Sabemos que estas células tienen funciones distintas, pero ¿qué les da a estas células sus identidades individuales? La respuesta está en cómo cada célula expresa la información contenida en su ADN. Las modificaciones epigenómicas, como la metilación del ADN, pueden controlar qué genes se activan o desactivan sin cambiar las letras del alfabeto del ADN (ATCG) y, por lo tanto, ayudar a distinguir diferentes tipos de células.
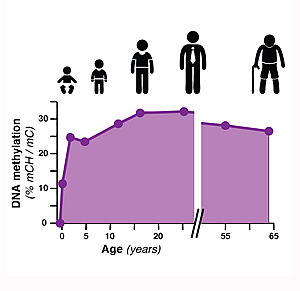
En este nuevo estudio, publicado el 4 de julio de 2013, en Ciencia:, los científicos descubrieron que los patrones de metilación del ADN experimentan una reconfiguración generalizada en la corteza frontal de los cerebros humanos y de ratones durante un período de desarrollo en el que las sinapsis, o conexiones entre las células nerviosas, crecen rápidamente. Los investigadores identificaron los sitios exactos de metilación del ADN en todo el genoma en cerebros desde bebés hasta adultos. Descubrieron que una forma de metilación del ADN está presente en las neuronas y la glía desde el nacimiento. Sorprendentemente, una segunda forma de metilación del ADN "no CG" que es casi exclusiva de las neuronas se acumula a medida que el cerebro madura, convirtiéndose en la forma dominante de metilación en el genoma de las neuronas humanas. Estos resultados nos ayudan a comprender cómo se desarrolla el intrincado paisaje de ADN de las células cerebrales durante las etapas clave de la infancia.
Un nuevo estudio realizado por investigadores de Salk proporciona los primeros mapas completos de cambios epigenómicos en el cerebro conocidos como "metilación del ADN", una modificación química del ADN de una célula que puede actuar como una capa adicional de información en el genoma.
El estudio proporciona pistas sobre cómo se regulan genes específicos en las células cerebrales fetales, juveniles y adultas, y los hallazgos forman una base fundamental para explorar si los cambios en los patrones de metilación pueden estar relacionados con enfermedades humanas, incluidos los trastornos psiquiátricos.
Imagen: Cortesía de Eran Mukamel, The Salk Institute for Biological Studies
El código genético del ADN se compone de cuatro bases químicas: adenina (A), guanina (G), citosina (C) y timina (T). La metilación del ADN generalmente ocurre en los llamados sitios CpG, donde la C (citosina) se encuentra junto a la G (guanina) en el alfabeto del ADN. Alrededor del 80 al 90 por ciento de los sitios CpG están metilados en el ADN humano. Los investigadores de Salk descubrieron previamente que en las células madre embrionarias humanas y las células madre pluripotentes inducidas, un tipo de célula madre derivada artificialmente, la metilación del ADN también puede ocurrir cuando G no sigue a C, por lo tanto, "metilación no CG". Originalmente, pensaron que este tipo de metilación desaparecía cuando las células madre se diferenciaban en tipos de tejido específicos, como células de pulmón o grasa. El estudio actual encuentra que este no es el caso en el cerebro, donde la metilación no CG aparece después de que las células se diferencian, generalmente durante la infancia y la adolescencia, cuando el cerebro está madurando.
Al secuenciar los genomas del tejido cerebral humano y de ratón, así como las neuronas y la glía (de la corteza frontal del cerebro) durante las primeras etapas posnatales, juveniles, adolescentes y adultas, el equipo de Salk descubrió que la metilación no CG se acumula en las neuronas durante las etapas tempranas. niñez y adolescencia, y se convierte en la forma dominante de metilación del ADN en las neuronas humanas maduras. "Esto demuestra que el período durante el cual maduran los circuitos neuronales del cerebro va acompañado de un proceso paralelo de reconfiguración a gran escala del epigenoma neuronal", dice Ecker, quien es un Instituto Médico Howard Hughes y Fundación Gordon y Betty Moore investigador.
El estudio proporciona los primeros mapas completos de cómo cambian los patrones de metilación del ADN en el ratón y el cerebro humano durante el desarrollo, formando una base fundamental para explorar ahora si los cambios en los patrones de metilación pueden estar relacionados con enfermedades humanas, incluidos los trastornos psiquiátricos. Estudios recientes han demostrado un posible papel de la metilación del ADN en la esquizofrenia, la depresión, el suicidio y el trastorno bipolar. "Nuestro trabajo nos permitirá comenzar a hacer preguntas más detalladas sobre cómo los cambios en el epigenoma esculpen las identidades complejas de las células cerebrales a lo largo de la vida", dice el coautor Eran Mukamel, de Salk's Laboratorio de Neurobiología Computacional.
"Se ha dicho que el cerebro humano es el sistema más complejo que conocemos en el universo", dice Ryan Lister, coautor correspondiente del nuevo artículo, anteriormente becario postdoctoral en el laboratorio de Ecker en Salk y ahora líder de grupo en La Universidad de Western Australia. “Así que quizás no deberíamos estar tan sorprendidos de que esta complejidad se extienda al nivel del epigenoma cerebral. Estas características únicas de la metilación del ADN que surgen durante las fases críticas del desarrollo del cerebro sugieren la presencia de procesos reguladores previamente no reconocidos que pueden estar involucrados de manera crítica en la función cerebral normal y los trastornos cerebrales”.
En la actualidad, existe consenso entre los neurocientíficos de que muchos trastornos mentales tienen un origen en el desarrollo neurológico y surgen de una interacción entre la predisposición genética y las influencias ambientales (por ejemplo, el estrés en la vida temprana o el abuso de drogas), cuyo resultado es una actividad alterada de las redes cerebrales. . La construcción y configuración de estas redes cerebrales requiere un largo proceso de maduración en el que los tipos de células del sistema nervioso central (neuronas y glía) necesitan afinar la forma en que expresan su código genético.
"La metilación del ADN cumple esta función", dice el coautor del estudio. Terrence J. Sejnowski, Investigador del Instituto Médico Howard Hughes, titular de la Cátedra Francis Crick y jefe de Salk's Laboratorio de Neurobiología Computacional. "Descubrimos que los patrones de metilación son dinámicos durante el desarrollo del cerebro, en particular para la metilación no CG durante la primera infancia y la adolescencia, lo que cambia la forma en que pensamos sobre la función y disfunción cerebral normal".
Al interrumpir la expresión transcripcional de las neuronas, agrega el coautor correspondiente M.Margarita Behrens, científico de plantilla del Laboratorio de Neurobiología Computacional, “las alteraciones de estos patrones de metilación cambiarán la forma en que se forman las redes, lo que podría, a su vez, conducir a la aparición de trastornos mentales más adelante en la vida”.
Otros investigadores del estudio fueron Joseph R. Nery, Mark Urich, Clare A. Puddifoot, Nicholas D. Johnson, Jacinto Lucero y Matthew D. Schultz del Instituto Salk; Julian Tonti-Filippini de la Universidad de Australia Occidental; Yun Huang y Anjana Rao de la Instituto La Jolla de Alergia e Inmunología; Miao Yu y Chuan He de la Universidad de Chicago; Andrew J. Dwork y Fatemeh G. Haghighi de la Universidad de Columbia; Holger Heyn y Manel Esteller de Instituto de Investigaciones Biomédicas de Bellvigte; y Shijun Hu y Joseph C. Wu del Stanford University School of Medicine.
El trabajo fue apoyado por el Instituto Nacional de Salud Mental, la Instituto Médico Howard Hughes, la Fundación Gordon y Betty Moore, la Instituto de California para la medicina regenerativa, la Sociedad de Leucemia y Linfoma, la Consejo Australiano de Investigación, y la Centro de Física Biológica Teórica de la Universidad de California, San Diego.
Sobre el Instituto Salk de Estudios Biológicos:
El Instituto Salk de Estudios Biológicos es una de las instituciones de investigación básica más importantes del mundo, donde profesores de renombre internacional investigan cuestiones fundamentales de las ciencias de la vida en un entorno único, colaborativo y creativo. Centrados tanto en el descubrimiento como en la orientación de futuras generaciones de investigadores, los científicos de Salk realizan contribuciones innovadoras a nuestra comprensión del cáncer, el envejecimiento, el Alzheimer, la diabetes y las enfermedades infecciosas mediante el estudio de la neurociencia, la genética, la biología celular y vegetal y disciplinas relacionadas.
Los logros de la facultad han sido reconocidos con numerosos honores, incluidos premios Nobel y membresías en la Academia Nacional de Ciencias. Fundado en 1960 por el pionero de la vacuna contra la polio Jonas Salk, MD, el Instituto es una organización independiente sin fines de lucro y un hito arquitectónico.
PERIODICO
Ciencia:
AUTORES
Ryan Lister, Eran A. Mukamel, Joseph R. Nery, Mark Urich, Clare A. Puddifoot, Nicholas D. Johnson, Jacinto Lucero, Yun Huang, Andrew J. Dwork, Matthew D. Schultz, Miao Yu, Julian Tonti-Filippini, Holger Heyn, Shijun Hu, Joseph C. Wu, Anjana Rao, Manel Esteller, Chuan He, Fatemeh G. Haghighi, Terrence J. Sejnowski, M. Margarita Behrens y Joseph R. Ecker
Oficina de Comunicaciones
Tel: (858) 453-4100
prensa@salk.edu