
Abril 24, 2008
La Jolla, CA – Un equipo de científicos del Instituto Salk de Estudios Biológicos cree saber cuántos, si no la mayoría, de los organismos vivos responden a esta pregunta. Recientemente demostraron que cuando los suministros de alimentos disminuyen, los mamíferos, las moscas de la fruta o las ranas probablemente activan la misma vía de señalización celular antigua para conservar energía.
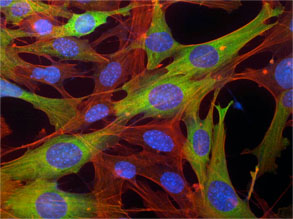
Leyenda: En respuesta al estrés energético, la AMPK, que actúa como un indicador de gas al detectar cuánta energía tiene una célula, frena la proliferación celular. Amortigua una proteína celular llamada raptor (que se muestra en verde), que evita que las células hambrientas se dividan. Los núcleos se muestran en azul y la actina, que forma parte integral de la arquitectura celular, se muestra en rojo.
Crédito: Imagen: Cortesía del Dr. Reuben Shaw, Instituto Salk de Estudios Biológicos
En un estudio publicado en la edición del 25 de abril de 2008 de Célula molecular, investigadores dirigidos por Rubén Shaw, Ph.D., profesor asistente en el Laboratorio de Biología Molecular y Celular del Centro Dulbecco para la Investigación del Cáncer, informan que cuando las células de los mamíferos detectan que la glucosa y otros nutrientes se están agotando, silencian una proteína celular llamada raptor, lo que hace que las células reduzcan la velocidad. su crecimiento.
Estos estudios no solo revelan estrategias de supervivencia probablemente comunes a organismos simples y complejos por igual, sino que también sugieren un vínculo extremadamente intrigante entre el cáncer y la diabetes.
“Este artículo proporciona la primera explicación bioquímica directa de cómo se inhibe el crecimiento celular en condiciones en las que los nutrientes son bajos”, informa Shaw. “Este circuito biológico muy simple es literalmente la señal básica que la mayoría de los organismos usan para decir: '¡Tenemos comida!' “
Los investigadores sabían que cuando este circuito fallaba, las células que se enfrentaban al hambre simplemente continuaban dividiéndose, ajenas a los tiempos difíciles y gastando energía como un comprador frenético con tarjeta de crédito, hasta que se agotaba el efectivo celular y las células morían. Lo que Shaw se preguntó fue si se habían identificado todos los componentes del circuito.
Usando células de ratón y humanas, Shaw y sus colegas observaron que cuando las células se mantienen hambrientas en una placa de cultivo, una enzima de vigilancia llamada AMPK entra en acción y une un grupo químico de fosfato a una proteína objetivo llamada raptor. Como resultado, raptor, cuyo trabajo es albergar una proteína promotora del crecimiento llamada mTOR, se desactiva, inactivando mTOR y deteniendo la división celular. Luego, las células cambian de manera segura al modo de conservación de energía hasta que regresen los tiempos abundantes.
Previamente, Shaw y otros habían demostrado que, aunque la AMPK desempeña una función crítica de ralentización del crecimiento, recibe órdenes de un gran jefe bioquímico, la proteína LKB1. LKB1 es un llamado supresor de tumores, lo que significa que su pérdida se correlaciona con la formación de crecimientos benignos, llamados hamartomas, y algunos tipos de cáncer maligno de pulmón y colon. Una vez que el LKB1 regulador del crecimiento quedó fuera de escena, muchos de estos tumores mostraron niveles muy altos de actividad mTOR no regulada.
Ahí es donde comenzaron las últimas investigaciones de Shaw. “Estábamos tratando de entender cómo la mutación del supresor de tumores LKB1 conduce al cáncer de colon o al cáncer de pulmón esporádico”, dice. “Había demostrado que LKB1 enciende AMPK, así que la siguiente pregunta era, ¿qué hace esa ¿hacer? Si regulaba el cáncer, tenía que haber componentes de la vía que regulaban el crecimiento celular que nadie había descubierto”.
Un colaborador, Benjamin Turk, Ph.D., de la Facultad de Medicina de la Universidad de Yale, ayudó a Shaw a identificar ese componente. AMPK es una quinasa, lo que significa que agrega grupos fosfato, que a veces se activan y otras veces se inhiben, a las proteínas objetivo. Usando los datos de Turk, Shaw peinó colecciones de fragmentos de proteínas bioquímicamente fosforilados por AMPK y extrajo uno correspondiente a un nuevo candidato a raptor. Sorprendentemente, esa pequeña parte de la proteína de raptor parecía similar en las proteínas de raptor expresadas en organismos que van desde mohos mucilaginosos hasta humanos.
Con rapaces como el principal sospechoso, la autora principal y estudiante graduada Dana Gwinn y otros miembros del laboratorio de Shaw llevaron a cabo extensos estudios bioquímicos para demostrar que AMPK de hecho fosforilaba directamente a rapaces en respuesta al estrés energético, que la actividad de mTOR luego disminuyó, y que de todo esto impidió que las células hambrientas se dividieran hasta que cayeron.
El estudio proporciona una visión asombrosa de la renuencia de la Madre Naturaleza a jugar con estrategias que satisfagan las necesidades más básicas de los organismos. “Simplemente, la información más rudimentaria que cualquier célula necesita es saber si hay comida alrededor, eso es lo que detecta AMPK. Si no lo hay, hay que desactivar los factores que hacen que las células crezcan”, explica Shaw, específicamente al equipo promotor del crecimiento de raptor y mTOR.
Y como si resolver acertijos evolutivos y diseccionar las vías supresoras de tumores no fuera suficiente, el trabajo general de Shaw sugiere una asociación clínica aún más profunda: la metformina, un fármaco ampliamente utilizado para la diabetes tipo 2, activa la AMPK, lo que sugiere que la vía LKB1/AMPK es un vínculo molecular entre la diabetes y el cáncer. “Este circuito podría explicar en parte el mayor riesgo de cáncer que se observa en los pacientes con diabetes tipo 2”, dice Shaw, y señala que muchos están predispuestos al cáncer de mama, próstata o colon.
¿Podrían las mutaciones en los componentes de la vía LKB1/AMPK ser la base de ambas patologías? Y si es así, ¿podrían los fármacos que antagonizan eficazmente la diabetes también antagonizar el crecimiento tumoral?
Esas preguntas son las siguientes en la agenda de Shaw. “No solo continuaremos analizando bioquímicamente esta vía, sino que probaremos más directamente si podemos tratar ciertos tipos de tumores en modelos de ratones con medicamentos para la diabetes”, dice Shaw.
También contribuyeron a este estudio desde el laboratorio de Shaw los becarios postdoctorales David Shackelford, Ph.D., y Annabelle Mery, Ph.D., la estudiante graduada Maria Mihaylova y los asistentes de investigación Debbie Vasquez y Daniel Egan.
El Instituto Salk de Estudios Biológicos en La Jolla, California, es una organización independiente sin fines de lucro dedicada a los descubrimientos fundamentales en las ciencias de la vida, la mejora de la salud humana y la capacitación de futuras generaciones de investigadores. Jonas Salk, MD, cuya vacuna contra la poliomielitis casi erradicó la poliomielitis, una enfermedad paralizante en 1955, inauguró el Instituto en 1965 con un terreno donado por la ciudad de San Diego y el apoyo financiero de March of Dimes.
Oficina de Comunicaciones
Tel: (858) 453-4100
prensa@salk.edu