
6 de septiembre de 2019
La investigación de Salk explica cómo las plantas pueden fabricar de manera eficiente los compuestos que utilizan para adaptarse al estrés
La investigación de Salk explica cómo las plantas pueden fabricar de manera eficiente los compuestos que utilizan para adaptarse al estrés
LA JOLLA—Las plantas pueden hacer muchas cosas asombrosas. Entre sus talentos, pueden fabricar compuestos que los ayuden a repeler plagas, atraer polinizadores, curar infecciones y protegerse del exceso de temperatura, la sequía y otros peligros ambientales.
Investigadores del Instituto Salk que estudian cómo las plantas desarrollaron la capacidad de producir estos químicos naturales han descubierto cómo evolucionó una enzima llamada chalcona isomerasa para permitir que las plantas elaboren productos vitales para su propia supervivencia. La esperanza de los investigadores es que este conocimiento informe la fabricación de productos que sean beneficiosos para los humanos, incluidos medicamentos y cultivos mejorados. El estudio apareció en la versión impresa de Catálisis ACS en septiembre 6, 2019.
Haga clic aquí para una imagen de alta resolución.
Crédito: Instituto Salk/Catálisis ACS
“Desde que las plantas terrestres aparecieron por primera vez en la Tierra hace aproximadamente 450 millones de años, han desarrollado un sofisticado sistema metabólico para transformar el dióxido de carbono de la atmósfera en una miríada de sustancias químicas naturales en sus raíces, brotes y semillas”, dice el profesor Salk. jose noel, el autor principal del artículo. “Esta es la culminación del trabajo que hemos estado haciendo en mi laboratorio durante los últimos 20 años, tratando de comprender la evolución química de las plantas. Nos brinda un conocimiento detallado sobre cómo las plantas han desarrollado esta capacidad única para producir algunas moléculas muy inusuales pero importantes”.
Investigaciones anteriores en el laboratorio de Noel observaron cómo evolucionaron estas enzimas a partir de proteínas no enzimáticas, incluido el estudio de versiones más primitivas de las mismas que aparecen en organismos como bacterias y hongos.
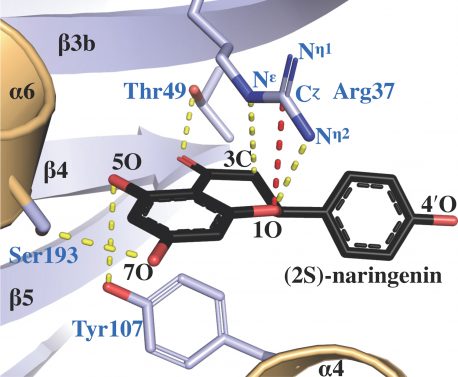
Como enzima, la chalcona isomerasa actúa como catalizador para acelerar las reacciones químicas en las plantas. También ayuda a garantizar que los productos químicos que se fabrican en la planta tengan la forma adecuada, ya que las moléculas con la misma fórmula química pueden tener dos variaciones diferentes que son imágenes especulares entre sí (llamadas isómeros).
"En la industria farmacéutica, es importante que los medicamentos que se fabrican sean la versión correcta, o el isómero, porque usar uno incorrecto puede provocar efectos secundarios no deseados", dice Noel, quien es director del Centro de Biología Química Jack H. Skirball de Salk. y proteómica y ocupa la cátedra Arthur and Julie Woodrow. "Al estudiar cómo funciona la chalcona isomerasa, podemos aprender más sobre cómo acelerar la fabricación de los isómeros correctos de los productos farmacéuticos y otros productos que pueden ser importantes para la salud humana".
En el estudio actual, los investigadores utilizaron varias técnicas de biología estructural para investigar la forma única de la enzima y cómo cambia su forma cuando interactúa con otras moléculas. Identificaron la parte de la estructura de la chalcona isomerasa que le permitía catalizar reacciones increíblemente rápidas y, al mismo tiempo, garantizar que produce el isómero biológicamente activo adecuado. Estas reacciones conducen a una gran cantidad de actividades en las plantas, incluida la conversión de metabolitos primarios como la fenilalanina y la tirosina en moléculas especializadas vitales llamadas flavonoides.
Resultó que un aminoácido en particular, la arginina, que era uno de los muchos aminoácidos unidos en la chalcona isomerasa, se encontraba en un lugar, moldeado por la evolución, que le permitía desempeñar un papel clave en cómo se catalizaban las reacciones de la chalcona isomerasa.

Haga clic aquí para una imagen de alta resolución.
Crédito: Instituto Salk
"Al realizar estudios estructurales y modelos informáticos, pudimos ver las posiciones muy precisas de la arginina dentro del sitio activo de la enzima a medida que avanzaba la reacción", dice el primer autor Jason Burke, exinvestigador postdoctoral en el laboratorio de Noel que ahora es profesor asistente en California. Universidad Estatal San Bernardino. “Sin esa arginina, no funciona de la misma manera”.
Burke añade que este tipo de catalizador ha sido buscado durante mucho tiempo por los químicos orgánicos. “Este es un ejemplo de cómo la naturaleza ya está resolviendo un problema que los químicos han estado analizando durante mucho tiempo”, agrega.
“Al comprender la isomerasa de chalcona, podemos crear un nuevo conjunto de herramientas que los químicos podrán usar para las reacciones que están estudiando”, dice Noel. "Es absolutamente vital tener este tipo de conocimiento fundamental para poder diseñar sistemas moleculares que puedan llevar a cabo una tarea particular incluso en la próxima generación de cultivos nutricionalmente densos capaces de transformar el dióxido de carbono, un gas de efecto invernadero, en moléculas esenciales para la vida".
Otros investigadores del artículo fueron James La Clair, Ryan Philippe, Joseph Jez, Marianne Bowman, Gordon Louie y Katherine Woods de Salk; Anna Pabis, Marina Corbella y Shina Kamerlin de la Universidad de Uppsala en Suecia; George Cortina de la Universidad de Virginia; Miriam Kaltenbach y Dan Tawfik del Instituto de Ciencias Weizmann en Israel; y Andrew Nelson de la Universidad de Texas en Austin.
Este trabajo también fue apoyado por el Instituto Médico Howard Hughes, la subvención EEC-0813570 de la Fundación Nacional de Ciencias de los Estados Unidos, las Fundaciones Wenner-Gren, el acuerdo de subvención ERC del Consejo Europeo de Investigación 30647 y una Beca de la Academia Wallenberg de la Fundación Knut y Alice Wallenberg. La Infraestructura Nacional Sueca para la Computación proporcionó el tiempo de computadora para las simulaciones realizadas en este estudio.
DOI: 10.1021/acscatal.9b01926
PERIODICO
Catálisis ACS
AUTORES
Jason R. Burke, James J. La Clair, Ryan N. Philippe, Anna Pabis, Marina Corbella, Joseph M. Jez, George A. Cortina, Miriam Kaltenbach, Marianne E. Bowman, Gordon V. Louie, Katherine B. Woods, Andrew T. Nelson, Dan S. Tawfik, Shina CL Kamerlin y Joseph P. Noel
Oficina de Comunicaciones
Tel: (858) 453-4100
prensa@salk.edu
Descubrir los secretos de la vida misma es la fuerza impulsora detrás del Instituto Salk. Nuestro equipo de científicos galardonados de clase mundial traspasa los límites del conocimiento en áreas como neurociencia, investigación del cáncer, envejecimiento, inmunobiología, biología vegetal, biología computacional y más. Fundado por Jonas Salk, desarrollador de la primera vacuna contra la polio segura y eficaz, el Instituto es una organización de investigación independiente y sin fines de lucro y un hito arquitectónico: pequeño por elección, íntimo por naturaleza y valiente ante cualquier desafío.