
26 de Octubre de 2012
El modelo de ratón puede proporcionar pistas sobre el mecanismo que vincula la diabetes y el envejecimiento con el Alzheimer
El modelo de ratón puede proporcionar pistas sobre el mecanismo que vincula la diabetes y el envejecimiento con el Alzheimer
LA JOLLA, CA—Evidencia creciente sugiere que puede haber un vínculo entre diabetes y La enfermedad de Alzheimer, pero los mecanismos fisiológicos por los cuales la diabetes afecta la función cerebral y la cognición no se comprenden completamente. En un nuevo estudio publicado en Envejecimiento celular, los investigadores del Instituto Salk de Estudios Biológicos muestran, por primera vez, que la diabetes mejora el desarrollo de las características del envejecimiento que pueden ser la base de los eventos patológicos tempranos en la enfermedad de Alzheimer.
Específicamente, el equipo de Salk encontró aumentos en dos características del Alzheimer: acumulaciones de beta amiloide (Abeta) y proteína tau, en el cerebro de ratones diabéticos, especialmente en las células que rodean los vasos sanguíneos. Abeta, el péptido mal plegado que se cree que en parte causa la enfermedad de Alzheimer, se agrega dentro de los astrocitos, células cerebrales en forma de estrella que, al interactuar con Abeta, liberan moléculas inflamatorias que pueden destruir las neuronas. Anteriormente, esto no se había demostrado en modelos de ratones con diabetes tipo 1 (T1D).

Investigador asociado Antonio Currais y Pamela Maher, científica sénior del personal del Laboratorio de Neurobiología Celular.
Imagen: Cortesía del Instituto Salk de Estudios Biológicos
"Nuestro estudio respalda y amplía los vínculos entre la diabetes, el envejecimiento y el Alzheimer", dice la autora principal Pamela Maher, científica principal del Salk's Laboratorio de Neurobiología Celular. "Demostramos que la diabetes tipo 1 aumenta la acumulación de beta amiloide asociada a los vasos en el cerebro y provoca un envejecimiento cerebral acelerado".
Los hallazgos sugieren que el sistema neurovascular puede ser un buen candidato para nuevos objetivos terapéuticos para tratar el Alzheimer en las primeras etapas de la enfermedad.
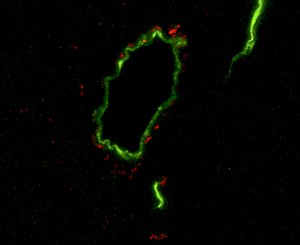
Esta imagen de microscopio muestra vasos sanguíneos en el cerebro de un ratón (verde) rodeados de péptidos beta amiloides (rojo), un componente de las placas amiloides que se encuentran en los cerebros de los pacientes con Alzheimer. Los investigadores de Salk descubrieron que estos péptidos se acumulan en los cerebros de ratones diabéticos y de edad avanzada, un hallazgo que puede ayudar a explicar la conexión entre la diabetes y el Alzheimer.
Imagen: Cortesía del Instituto Salk de Estudios Biológicos
El Alzheimer y la diabetes son dos enfermedades que están aumentando a un ritmo alarmante entre la población estadounidense. El Alzheimer afecta a uno de cada 10 estadounidenses mayores de 65 años y a casi el 50 por ciento de los mayores de 85. De manera similar, más del 8 por ciento de los estadounidenses (aproximadamente 26 millones de personas) tienen diabetes, y la gran mayoría de esas personas tienen más de 60 años.
Maher dice que su equipo no está seguro del mecanismo preciso detrás del aumento de Abeta y tau en el cerebro del ratón, pero sus datos sugieren que los cambios en los astrocitos, así como otros procesos proinflamatorios y la unión de proteínas con moléculas de azúcar (llamadas no -glicación enzimática), puede contribuir.
"Los astrocitos juegan un papel clave en el mantenimiento de las células nerviosas en el cerebro", dice el autor principal del estudio, Antonio Currais, investigador postdoctoral en Salk. "Tanto la inflamación periférica crónica como el aumento de la glucosilación no enzimática están asociados con la diabetes, y estos cambios pueden actuar en el cerebro para alterar la función de los astrocitos, lo que eventualmente conduce a cambios similares a los del Alzheimer".
Todas las células nerviosas están estrechamente conectadas con los vasos sanguíneos, ya que necesitan nutrientes, especialmente glucosa (azúcar) y oxígeno, proporcionados por la sangre para funcionar. Los astrocitos facilitan la transferencia de nutrientes entre los vasos sanguíneos y las células. La acumulación de Abeta en los sitios donde los astrocitos interactúan con los vasos sanguíneos sugiere que esto podría afectar la transferencia de nutrientes. El tipo de localización de Abeta que se observa en los modelos de ratón de Maher también se encuentra en pacientes humanos con Alzheimer.
Para examinar las contribuciones de la diabetes a la patología relacionada con el Alzheimer en el cerebro anciano, los investigadores de Salk indujeron la DT1 en dos conjuntos de modelos de ratones. Un conjunto, conocido como ratones SAMP8, sufre un envejecimiento acelerado y desarrolla un deterioro temprano en el aprendizaje y la memoria, así como una serie de alteraciones cerebrales similares a las que se encuentran en el Alzheimer. El otro conjunto, los ratones SAMR1, que en este estudio provenían del mismo conjunto de genes que los ratones SAMP8, envejecen normalmente.
Usando estos ratones, Maher y sus colegas abordaron cómo la DT1 interactúa con la edad para contribuir a la patología relacionada con el Alzheimer. Demostraron que la diabetes Tipo 1 provoca una amplia gama de cambios patológicos en los cerebros de ambas cepas de ratones, que se ven exacerbados por el envejecimiento prematuro.
El estudio de Salk es el primero en mostrar que estas modificaciones son similares a las observadas en ratones SAMP8 viejos no diabéticos y en identificar cambios patológicos únicos, como aumentos en los marcadores de inflamación, en ratones SAMP1 T8D de edad avanzada.
A diferencia de la mayoría de los estudios con ratones sobre la enfermedad de Alzheimer, los ratones de Maher no fueron diseñados para producir altos niveles de Abeta o tau humanos, por lo que todas sus observaciones provinieron de Abeta y tau naturales.
Otros investigadores del estudio fueron Marguerite Prior y el profesor David Schubert, del Salk's Laboratorio de Neurobiología Celular; David Lo, de Salk's Laboratorio de Estructura y Función Neuronal; y Corinne Jolivalt de la Universidad de California, San Diego.
El trabajo fue apoyado por el Los Institutos Nacionales de Salud, la Fundación Fritz B. Burns, la Fundación Bundy, la Fundação para a Ciência ea Tecnologia y la Asociación de Alzheimer.
Sobre el Instituto Salk de Estudios Biológicos:
El Instituto Salk de Estudios Biológicos es una de las instituciones de investigación básica más importantes del mundo, donde profesores de renombre internacional investigan cuestiones fundamentales de las ciencias de la vida en un entorno único, colaborativo y creativo. Centrados tanto en el descubrimiento como en la orientación de futuras generaciones de investigadores, los científicos de Salk realizan contribuciones innovadoras a nuestra comprensión del cáncer, el envejecimiento, el Alzheimer, la diabetes y las enfermedades infecciosas mediante el estudio de la neurociencia, la genética, la biología celular y vegetal y disciplinas relacionadas.
Los logros de la facultad han sido reconocidos con numerosos honores, incluidos premios Nobel y membresías en la Academia Nacional de Ciencias. Fundado en 1960 por el pionero de la vacuna contra la polio Jonas Salk, MD, el Instituto es una organización independiente sin fines de lucro y un hito arquitectónico.
PERIODICO
Envejecimiento celular
TÍTULO
La diabetes exacerba la patología neurovascular y amiloide en ratones con envejecimiento acelerado
AUTORES
Antonio Currais, Marguerite Prior, David Lo, Corinne Jolivalt, David Schubert y Pamela Maher
Oficina de Comunicaciones
Tel: (858) 453-4100
prensa@salk.edu