
Abril 24, 2018
Los científicos de Salk desarrollan un nuevo modelo para el glioblastoma utilizando organoides editados genéticamente
Los científicos de Salk desarrollan un nuevo modelo para el glioblastoma utilizando organoides editados genéticamente
LA JOLLA—El glioblastoma multiforme (GBM) es un cáncer cerebral increíblemente mortal y presenta un serio desafío de caja negra. Es virtualmente imposible observar cómo funcionan estos tumores en su entorno natural y los modelos animales no siempre brindan buenas respuestas.
Pero ahora, los investigadores del Instituto Salk han dado un paso importante para enfrentar ese desafío. Al editar dos genes en solo unas pocas células en organoides cerebrales humanos, los científicos de Salk generaron tumores GBM agresivos. Este nuevo modelo podría usarse para estudiar la progresión del tumor, investigar nuevos medicamentos o incluso personalizar los tratamientos para los pacientes. El estudio fue publicado en la revista Cell Reports de abril 24, 2018.
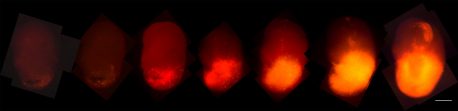
Haga clic aquí para una imagen de alta resolución.
Crédito: Instituto Salk/Centro Waitt
Uno de los problemas que afectan a los ensayos clínicos es que, con bastante frecuencia, los medicamentos que funcionan en animales no funcionan en personas. Los investigadores han tratado de superar esto mediante el uso de xenoinjertos, en los que el tejido tumoral del paciente se implanta en modelos animales, pero este enfoque tiene sus propios problemas. A veces, no hay suficiente tejido tumoral humano para estudiar y, con el tiempo, los tumores se adaptan a su nuevo hogar.
"A medida que los tumores crecen en los ratones, el entorno cambia las características del tumor", dice Junko Ogawa, investigador asociado principal de Salk y primer autor del artículo. “No sabemos si es similar al cáncer original del paciente”.
La solución podría ser organoides cerebrales humanos, que contienen neuronas y otras células cerebrales. El laboratorio Salk ha estado usando células madre para generar estas pequeñas estructuras 4D (alrededor de 3 mm) en un plato durante algún tiempo y quería investigar cómo podrían aplicarse para estudiar GBM.
Utilizaron la herramienta CRISPR-Cas9 para editar dos genes estrechamente asociados con el cáncer, HRas y p53, en unas pocas células de un organoide. HRas es un oncogén del cáncer que impulsa el crecimiento celular desenfrenado, mientras que p53 es un supresor de tumores. En otras palabras, quitaron el pie del freno y pisaron el acelerador.
Estos organoides se convirtieron en estructuras similares a tumores en el plato: crecieron de forma agresiva y tenían varios biomarcadores asociados con GBM. Eventualmente, se hicieron cargo de los organoides, reemplazando las células originales con tejido tumoral. Además, podían trasplantarse en serie a modelos animales, donde también eran bastante agresivos.

Haga clic aquí para una imagen de alta resolución
Crédito: Instituto Salk
Este enfoque ofrece una serie de ventajas. La edición de p53 y HRas en solo unas pocas células replica mejor cómo se desarrollan realmente los GBM en las personas: no comienzan como miles de células a la vez (como un xenoinjerto), sino como una o dos células aberrantes.
El equipo agregó un marcador rojo fluorescente, llamado tdTomato, al HRas oncogénico. A medida que esas células se hicieron cargo de los organoides, los investigadores pudieron seguir su progresión. Además, cuando los tumores organoides se trasplantaron a los cerebros de los ratones, crecieron rápidamente y se asemejaron a los tumores extraídos de los pacientes, lo que ofreció un acceso más fácil a las muestras.
“Puedes fenocopiar las propiedades de los tumores en un ratón”, dice Ogawa, “y ahora podemos darles medicamentos para ver si son efectivos. También podemos probar la capacidad del tumor para invadir el tejido cerebral normal”.
Estos organoides también podrían albergar muestras de tumores humanos y algunas líneas celulares de GBM. Este modelo podría utilizarse para personalizar la atención. Los investigadores y los médicos podrían trasplantar las células cancerosas de los pacientes para hacer modelos organoides. Como resultado, podrían estudiar cómo responde un tumor al tratamiento en células que coinciden con el genoma del paciente. Si bien los organoides carecen de células endoteliales y de un sistema inmunológico (que les daría más complejidad y les ayudaría a replicar mejor el tejido cerebral real), este modelo podría ser muy útil para estudiar una variedad de cánceres metastásicos cerebrales, no solo GBM.
Este trabajo fue financiado por los Institutos Nacionales de Salud (R01CA095613, P30 CA014195-38, P30 014195, P30 014195 y P30 014195), la Fundación HN y Frances C. Berger, Leona M. y Harry B. Helmsley Charitable Trust (subvención 2017-PG-MED001), el Centro Glenn para la Investigación del Envejecimiento y la Fundación Chapman.
PERIODICO
Cell Reports
AUTORES
Junko Ogawa, Gerald M. Pao, Maxim N. Shokhirev e Inder M. Verma
Oficina de Comunicaciones
Tel: (858) 453-4100
prensa@salk.edu
Descubrir los secretos de la vida misma es la fuerza impulsora detrás del Instituto Salk. Nuestro equipo de científicos galardonados de clase mundial traspasa los límites del conocimiento en áreas como neurociencia, investigación del cáncer, envejecimiento, inmunobiología, biología vegetal, biología computacional y más. Fundado por Jonas Salk, desarrollador de la primera vacuna contra la polio segura y eficaz, el Instituto es una organización de investigación independiente y sin fines de lucro y un hito arquitectónico: pequeño por elección, íntimo por naturaleza y valiente ante cualquier desafío.