
13 de Julio de 2022
Los hallazgos podrían conducir a nuevos tratamientos para el síndrome de Wiskott-Aldrich
Los hallazgos podrían conducir a nuevos tratamientos para el síndrome de Wiskott-Aldrich
LA JOLLA—Investigadores del Instituto Salk y la Universidad de Ciencia y Tecnología King Abdullah (KAUST) en Arabia Saudita han descubierto una nueva causa subyacente del síndrome de Wiskott-Aldrich, una rara enfermedad genética que provoca sangrado y deficiencias inmunitarias en los bebés. Sus hallazgos, publicados en la revista Nature Communications el 25 de junio de 2022, gira en torno a cómo las células cortan y pegan hebras de ARN en un proceso llamado empalme de ARN. Descubrieron que las mutaciones genéticas asociadas con el síndrome de Wiskott-Aldrich interrumpen este proceso que, a su vez, impide que numerosas proteínas inmunitarias y antiinflamatorias se produzcan correctamente.
"Este estudio no solo sugiere nuevos objetivos para tratar el síndrome de Wiskott-Aldrich con fármacos de molécula pequeña, sino que también arroja nueva luz sobre la biología básica del empalme del ARN, un proceso importante y no del todo comprendido", dice el coautor correspondiente. Juan Carlos Izpisúa Belmonte, profesor del Laboratorio de Expresión Génica de Salk y titular de la Cátedra Roger Guillemin.
Los bebés con el síndrome de Wiskott-Aldrich comienzan a desarrollar síntomas rápidamente después del nacimiento: picazón, erupciones escamosas, hematomas frecuentes y hemorragias nasales son algunos de los primeros signos. Con el tiempo, se vuelven propensos a las infecciones y son más propensos que otros niños a desarrollar enfermedades autoinmunes y cánceres. La única cura potencial es un trasplante de médula ósea, que conlleva una serie de complicaciones y solo funciona en algunos niños.
Los científicos saben desde hace mucho tiempo que el síndrome de Wiskott-Aldrich es causado por mutaciones en un gen en el cromosoma X; el gen y la proteína que codifica se denominaron WASP por el síndrome. La proteína WASP se encuentra en todas las células de la sangre y el sistema inmunitario, y una de sus funciones es mantener los citoesqueletos de estas células, las redes microscópicas de proteínas que dan forma y organización a las células. Pero los cambios en el citoesqueleto no pudieron explicar todos los síntomas.
El ex becario postdoctoral de Salk, Mo Li, ahora director del Laboratorio de Células Madre y Regeneración de KAUST, e Izpisua Belmonte se preguntaron si WASP desempeña otras funciones, particularmente en los núcleos de las células sanguíneas e inmunitarias, donde se almacena y procesa el material genético.
Para averiguarlo, eliminaron el gen WASP de las células madre y persuadieron a las células para que se convirtieran en macrófagos o células B, dos tipos de células inmunitarias afectadas por la enfermedad. También recogieron células de dos pacientes con síndrome de Wiskott-Aldrich y generaron células madre pluripotentes inducidas (iPSC) que contenían las mutaciones asociadas a la enfermedad en WASP. Luego compararon las células alteradas con macrófagos y células B normales.

"Estos son modelos poderosos que pueden ayudarnos a comprender cómo funciona WASP y cuáles son los mecanismos celulares subyacentes del síndrome de Wiskott-Aldrich", dice Li.
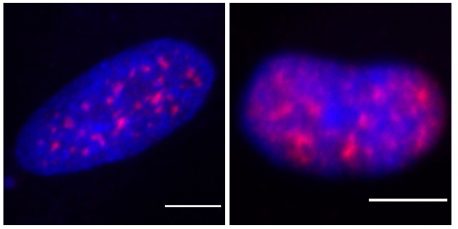
Las células inmunitarias que carecían de WASP, o que contenían mutaciones en el gen WASP, parecían diferentes de inmediato; había muchos más grupos, conocidos como motas nucleares, en los centros de las células enfermas. Para que una célula produzca una proteína, el ADN que la codifica se transcribe primero en una cadena de ARN. A menudo, esta hebra inicial contiene más material genético del necesario; aquí es donde entra en juego el empalme de ARN. Las proteínas en las motas nucleares cortan y pegan fragmentos de la hebra de ARN inicial en sus instrucciones finales para una proteína.
"Cuando vimos diferencias en las motas nucleares de estas células, esta es la primera vez que nos dimos cuenta de que WASP podría estar involucrado en el empalme del ARN", dice Baolei Yuan, estudiante de posgrado de KAUST y primer autor del nuevo artículo.
Los investigadores también demostraron que muchas proteínas relacionadas con el empalme del ARN estaban presentes en niveles más altos en las células que carecían de WASP o que presentaban mutaciones en WASP. WASP controlaba la producción de estos factores de empalme de ARN y desempeñaba un papel directo en el empalme del ARN. El equipo identificó miles de otros genes con empalme de ARN alterado; muchos estaban relacionados con la inflamación, la autoinmunidad y el cáncer.
Experimentos adicionales revelaron que la reparación de mutaciones WASP corrige estos defectos de empalme de ARN. Además, la reducción de los niveles de un factor de empalme de ARN, SRSF2, puede prevenir los problemas. Estos resultados sugieren que los medicamentos dirigidos a SRSF2 podrían tratar el síndrome de Wiskott-Aldrich en humanos, dicen los investigadores.
“Estos factores de empalme de ARN podrían ser un biomarcador para monitorear el síndrome de Wiskott-Aldrich y un objetivo potencial para el tratamiento”, dice Izpisua Belmonte.
Se necesita más trabajo para comprender exactamente cómo WASP está empalmando el ARN, así como qué síntomas del síndrome de Wiskott-Aldrich están asociados con el empalme anormal del ARN que se observa en las células enfermas.
Izpisua Belmonte es actualmente Directora de Instituto de Altos Labs Inc., además de ser profesora del Instituto Salk.
Otros autores incluyen a Keiichiro Suzuki, Sarah Dunn, Reyna Hernandez-Benitez, Tomoaki Hishida, Na Young Kim, Manching Ku, Yuta Takahashi, Ling Huang, Christopher Benner, Emi Aizawa, Zhongwei Li, Fei Yi, Maxim Shokhirev y Concepcion Rodriguez Esteban de Salk. ; Xuan Zhou, Gerardo Ramos-Mandujano, Mengge Wang, Muhammad Tehseen, Lorena V. Cortés-Medina, Manal M. Andijani, Chongwei Bi, Jinna Xu, Yanal Ghosheh y Samir Hamdan de KAUST; James J. Moresco y John R. Yates del Instituto de Investigación Scripps; Jinsong Qiu, Changwei Shao y Xiang-Dong Fu de UC San Diego; Jing Qu y Guang-Hui Liu de la Academia China de Ciencias; Patrizia Comoli de la Fondazione IRCCS Policlinico San Matteo; y Francesco Frassoni del Instituto Científico del Hospital Infantil G. Gaslini.
El trabajo fue apoyado en parte por la Oficina de Investigación Patrocinada de KAUST (BAS/1/1080-01 y URF/1/4716-01), Waitt Advanced Biophotonics Core Facility del Salk Institute con financiamiento de NIH-NCI CCSG (P30 014195 ), NINDS Neuroscience Core Grant, Waitt Foundation, Programa Nacional de Investigación y Desarrollo Clave de China (2020YFA0804000), Programa de Investigación de Prioridad Estratégica de la Academia China de Ciencias (XDA16010000), Fundación Nacional de Ciencias Naturales de China (81921006, 92149301, 92168201), Moxie Foundation y G. Harold y Leila Y. Mathers Charitable Foundation.
DOI: 10.1038/s41467-022-31220-8
PERIODICO
Nature Communications
AUTORES
Baolei Yuan, Xuan Zhou, Keiichiro Suzuki, Gerardo Ramos-Mandujano, Mengge Wang, Muhammad Tehseen, Lorena V. Cortés-Medina, James J. Moresco, Sarah Dunn, Reyna Hernandez-Benitez, Tomoaki Hishida, Na Young Kim, Manal M. Andijani, Chongwei Bi, Manching Ku, Yuta Takahashi, Jinna Xu, Jinsong Qiu, Ling Huang, Christopher Benner, Emi Aizawa, Jing Qu, Guang-Hui Liu, Zhongwei Li, Fei Yi, Yanal Ghosheh, Changwei Shao, Maxim Shokhirev, Patrizia Comoli, Francesco Frassoni, John R. Yates III, Xiang-Dong Fu, Concepción Rodríguez Esteban, Samir Hamdan, Mo Li and Juan Carlos Izpisua Belmonte
Oficina de Comunicaciones
Tel: (858) 453-4100
prensa@salk.edu
Descubrir los secretos de la vida misma es la fuerza impulsora detrás del Instituto Salk. Nuestro equipo de científicos galardonados de clase mundial traspasa los límites del conocimiento en áreas como neurociencia, investigación del cáncer, envejecimiento, inmunobiología, biología vegetal, biología computacional y más. Fundado por Jonas Salk, desarrollador de la primera vacuna contra la polio segura y eficaz, el Instituto es una organización de investigación independiente y sin fines de lucro y un hito arquitectónico: pequeño por elección, íntimo por naturaleza y valiente ante cualquier desafío.