
Enero 8, 2016
Tener en cuenta cómo se propagan los tumores malignos también puede ser clave para el tratamiento
Tener en cuenta cómo se propagan los tumores malignos también puede ser clave para el tratamiento
LA JOLLA: el glioblastoma multiforme es un células cancerosas. Una persona diagnosticada con este tipo de tumor cerebral generalmente sobrevive 15 meses, si recibe la mejor atención. El difunto senador Ted Kennedy sucumbió a esta enfermedad en poco más de un año.
Pero los científicos del Instituto Salk han descubierto una clave de cómo estas células tumorales proliferan tan rápidamente y formas de convertir este motor de crecimiento tumoral en un objetivo para el tratamiento del cáncer.
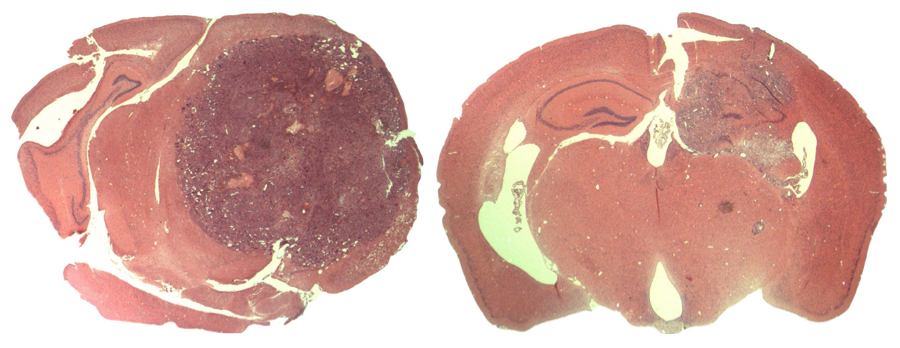
Haga clic aquí para descargar una imagen de alta resolución.
Imagen: Cortesía del Instituto Salk de Estudios Biológicos
“Esta es una enfermedad para la que prácticamente no ha habido mejoras en el resultado del tratamiento durante años”, dijo Inder Verma, profesor del Laboratorio de Genética del Instituto Salk y autor principal del artículo publicado el 8 de enero de 2016 en la revista Science Advances. “Está claro que incluso si un cirujano extirpa el 99.99 por ciento de un tumor de glioblastoma multiforme, lo que quede volverá y se convertirá en más tumor”.
Para estudiar cómo se propaga el glioblastoma multiforme, el equipo de Verma se centró en un factor de transcripción llamado factor nuclear kB (o NF-kB). Un factor de transcripción es una proteína que se une al ADN y controla el destino de la expresión génica para un conjunto particular de genes. Varios factores conocidos pueden desencadenar la actividad de NF-kB en una célula, incluida la radiación ultravioleta e ionizante, las proteínas inmunitarias (citocinas) y el daño del ADN.
En el caso del glioblastoma multiforme, Verma y sus colegas realizaron una serie de pruebas para mostrar cómo la actividad excesivamente entusiasta de NF-kB empujaba a las células cancerosas a proliferar y cómo detener el NF-kB ralentizaba el crecimiento del cáncer y aumentaba la supervivencia en ratones.
“Nuestros experimentos confirmaron que se requiere NF-kB para que la célula cancerosa prolifere”, dice Dinorah Friedmann-Morvinski, primera autora del artículo y actualmente investigadora en el departamento de bioquímica y biología molecular de la Universidad de Tel Aviv en Israel. “Pero ahora finalmente hemos encontrado una manera de mejorar el tumor para aumentar la vida útil”.
El equipo de Verma comenzó con un modelo de ratón de glioblastoma multiforme y utilizó herramientas genéticas para manipular las células para que detuvieran la actividad de NF-kB de dos maneras. El equipo aumentó la presencia de una proteína llamada IkBaM, que inhibe la actividad de NF-kB. También eliminaron una enzima que aumenta la actividad de NF-kB. Con menos actividad de NF-kB, el crecimiento del tumor se ralentizó y los ratones vivieron significativamente más que los ratones cuya actividad de NF-kB se mantuvo sola. Pero si bien estos experimentos genéticos demostraron el papel de NF-kB en el glioblastoma multiforme, no son un tratamiento factible en humanos.
“Entonces preguntamos cómo podríamos manipular el sistema utilizando la farmacología en lugar de la genética”, dice Verma.
Los científicos han sospechado durante mucho tiempo que una de las razones por las que el glioblastoma multiforme regresa tan rápido después de la cirugía es el llamado microambiente tumoral. En otras palabras, un tumor cambia el entorno de su entorno (tejidos cercanos) para facilitar el crecimiento de las células cancerosas, explica Verma.

Haga clic aquí para descargar una imagen de alta resolución.
Imagen: Cortesía del Instituto Salk de Estudios Biológicos
En lugar de usar herramientas genéticas, Verma y sus colegas buscaron tratar los tumores cerebrales de una manera que también cambiara el microambiente tumoral. Los científicos alimentaron a los ratones con un péptido (llamado NBD) que se sabe que bloquea la actividad de NF-kB cuando las citocinas (proteínas producidas por el sistema inmunitario) activan NF-kB. El péptido NBD viaja fácilmente a través del sistema nervioso central y puede penetrar con éxito en las células tumorales de glioblastoma. El tratamiento de ratones con el péptido NBD duplicó su tiempo de supervivencia típico en comparación con los ratones que no recibieron el péptido NBD.
“Podríamos aumentar el tiempo de supervivencia de un mes sin tratamiento a tres meses con tratamiento”, dice Verma. "Eso es un aumento profundo en la esperanza de vida, especialmente considerando que un ratón solo vive dos años". Sin embargo, mientras que el péptido NBD mantuvo a raya a los tumores, el tratamiento con péptidos eventualmente causa toxicidad, muy probablemente en el hígado. Entonces, los investigadores exploraron otra táctica para ralentizar la actividad de NF-kB.
Frenar la actividad de NF-kB puede ser complicado porque NF-kB tiene muchas funciones importantes: ayuda a regular la supervivencia celular, la inflamación y la inmunidad, entre muchas otras funciones en la célula.
“El objetivo final es bloquear NF-kB, pero debido a que activa muchos genes, al menos 100, nuestro objetivo se convirtió en encontrar el puñado de genes que afectan directamente el crecimiento del tumor”, dice Verma. “Entonces podemos ser más selectivos en el tratamiento”.
Los científicos de Salk rastrearon qué genes estaban influenciados por NF-kB y encontraron uno, Timp1, que anteriormente se había implicado en el cáncer de pulmón. Apuntar al gen Timp1 en el tratamiento también ralentizó el crecimiento del tumor y aumentó el tiempo de supervivencia en ratones en unos pocos meses.
“En el futuro, queremos centrarnos en formas de reducir la toxicidad de los fármacos anti-NF-kB”, dijo Friedmann-Morvinski. "Podemos hacer esto dirigiendo específicamente estos medicamentos al tumor, o identificando objetivos aguas abajo de la vía NF-kB, como Timp1, que también prolongan la supervivencia". Otros experimentos pueden identificar tratamientos que se dirijan a la actividad de NF-kB de una manera segura pero efectiva.
Otros autores del artículo incluyeron a Rajesh Narasimamurthy, Yifeng Xia, Chad Myskiw y Yasushi Soda del Instituto Salk de Estudios Biológicos.
El trabajo fue financiado por la Los Institutos Nacionales de Salud, la Fundación HN y Frances C. Berger, y la Leona M. y Harry B. Helmsley Charitable Trust.
PERIODICO
Science Advances
AUTORES
Dinorah Friedmann-Morvinski, Rajesh Narasimamurthy, Yifeng Xia, Chad Myskiw, Yasushi Soda, Inder M. Verma
Oficina de Comunicaciones
Tel: (858) 453-4100
prensa@salk.edu
Descubrir los secretos de la vida misma es la fuerza impulsora detrás del Instituto Salk. Nuestro equipo de científicos galardonados de clase mundial traspasa los límites del conocimiento en áreas como neurociencia, investigación del cáncer, envejecimiento, inmunobiología, biología vegetal, biología computacional y más. Fundado por Jonas Salk, desarrollador de la primera vacuna contra la polio segura y eficaz, el Instituto es una organización de investigación independiente y sin fines de lucro y un hito arquitectónico: pequeño por elección, íntimo por naturaleza y valiente ante cualquier desafío.