
Abril 30, 2015
Los hallazgos del Instituto Salk sobre el síndrome de envejecimiento prematuro podrían conducir a una forma de ralentizar o revertir el proceso de envejecimiento
Los hallazgos del Instituto Salk sobre el síndrome de envejecimiento prematuro podrían conducir a una forma de ralentizar o revertir el proceso de envejecimiento
LA JOLLA–Un estudio que relaciona el proceso de envejecimiento con el deterioro de paquetes de ADN celular empaquetados de forma compacta podría conducir a métodos para prevenir y tratar enfermedades relacionadas con la edad, como el cáncer, la diabetes y la enfermedad de Alzheimer, como se detalla el 30 de abril de 2015, en Ciencia:.
En el estudio, los científicos del Instituto Salk y el Academia China de Ciencias descubrió que las mutaciones genéticas subyacentes al síndrome de Werner, un trastorno que conduce al envejecimiento prematuro y la muerte, dieron como resultado el deterioro de los paquetes de ADN conocidos como heterocromatina.
El descubrimiento, hecho posible gracias a una combinación de tecnologías de edición de genes y células madre de vanguardia, podría conducir a formas de contrarrestar el deterioro fisiológico relacionado con la edad al prevenir o revertir el daño a la heterocromatina.
“Nuestros hallazgos muestran que la mutación del gen que causa el síndrome de Werner da como resultado la desorganización de la heterocromatina, y que esta interrupción del empaquetamiento normal del ADN es un factor clave del envejecimiento”, dice. Juan Carlos Izpisúa Belmonte, autor principal del artículo. "Esto tiene implicaciones más allá del síndrome de Werner, ya que identifica un mecanismo central del envejecimiento, la desorganización de la heterocromatina, que se ha demostrado que es reversible".
El síndrome de Werner es un trastorno genético que hace que las personas envejezcan más rápido de lo normal. Afecta a alrededor de una de cada 200,000 personas en los Estados Unidos. Las personas con este trastorno sufren enfermedades relacionadas con la edad a temprana edad, como cataratas, diabetes tipo 2, endurecimiento de las arterias, osteoporosis y cáncer, y la mayoría muere entre los 40 y los 50 años.
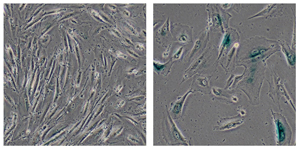
Los investigadores del Instituto Salk descubrieron que una proteína mutada en el trastorno de envejecimiento prematuro, el síndrome de Werner, desempeña un papel clave en la estabilización de la heterocromatina, una forma de ADN estrechamente empaquetada. En términos más generales, los hallazgos sugieren que la desorganización de la heterocromatina puede ser un factor clave del envejecimiento. Esta imagen muestra células humanas normales (izquierda) y células modificadas genéticamente desarrolladas por los científicos de Salk para modelar el síndrome de Werner (derecha), que mostraban signos de envejecimiento, incluido su gran tamaño.
Haga clic aquí para una imagen de alta resolución.
Imagen: Cortesía del Instituto Salk de Estudios Biológicos
La enfermedad es causada por una mutación en el gen similar a la helicasa RecQ del síndrome de Werner, conocido como el gen WRN para abreviar, que genera la proteína WRN. Estudios anteriores demostraron que la forma normal de la proteína es una enzima que mantiene la estructura y la integridad del ADN de una persona. Cuando la proteína muta en el síndrome de Werner, interrumpe la replicación y reparación del ADN y la expresión de genes, lo que se pensaba que causaba el envejecimiento prematuro. Sin embargo, no estaba claro exactamente cómo la proteína WRN mutada interrumpía estos procesos celulares críticos.
En su estudio, los científicos de Salk buscaron determinar con precisión cómo la proteína WRN mutada causa tanto caos celular. Para hacer esto, crearon un modelo celular del síndrome de Werner mediante el uso de una tecnología de edición de genes de vanguardia para eliminar el gen WRN en células madre humanas. Este modelo de células madre de la enfermedad les dio a los científicos la capacidad sin precedentes de estudiar las células que envejecen rápidamente en el laboratorio. Las células resultantes imitaron la mutación genética observada en pacientes reales con síndrome de Werner, por lo que las células comenzaron a envejecer más rápidamente de lo normal. En un examen más detallado, los científicos encontraron que la eliminación del gen WRN también provocó alteraciones en la estructura de la heterocromatina, el ADN muy compacto que se encuentra en el núcleo de una célula.
Este conjunto de ADN actúa como un panel de control para controlar la actividad de los genes y dirige la compleja maquinaria molecular de una célula. En el exterior de los haces de heterocromatina hay marcadores químicos, conocidos como etiquetas epigenéticas, que controlan la estructura de la heterocromatina. Por ejemplo, las alteraciones de estos interruptores químicos pueden cambiar la arquitectura de la heterocromatina, lo que hace que los genes se expresen o silencien.

Desde la izquierda: Pradeep Reddy, Concepción Rodríguez Esteban, Emi Suzuki, Mo Li, Juan Carlos Izpisua Belmonte, Alejandro Ocampo, Keiichiro Suzuki
Haga clic aquí para una imagen de alta resolución.
Imagen: Cortesía del Instituto Salk de Estudios Biológicos
Los investigadores de Salk descubrieron que la eliminación del gen WRN conduce a la desorganización de la heterocromatina, lo que apunta a un papel importante de la proteína WRN en el mantenimiento de la heterocromatina. Y, de hecho, en experimentos posteriores, demostraron que la proteína interactúa directamente con las estructuras moleculares conocidas por estabilizar la heterocromatina, lo que revela una especie de prueba irrefutable que, por primera vez, vincula directamente la proteína WRN mutada con la desestabilización de la heterocromatina.
“Nuestro estudio conecta los puntos entre el síndrome de Werner y la desorganización de la heterocromatina, delineando un mecanismo molecular por el cual una mutación genética conduce a una interrupción general de los procesos celulares al interrumpir la regulación epigenética”, dice Izpisua Belmonte. “En términos más generales, sugiere que las alteraciones acumuladas en la estructura de la heterocromatina pueden ser una de las principales causas subyacentes del envejecimiento celular. Esto plantea la pregunta de si podemos revertir estas alteraciones, como remodelar una casa o un automóvil viejos, para prevenir, o incluso revertir, el deterioro y las enfermedades relacionadas con la edad”.
Izpisua Belmonte agregó que se necesitarán estudios más extensos para comprender completamente el papel de la desorganización de la heterocromatina en el envejecimiento, incluida la forma en que interactúa con otros procesos celulares implicados en el envejecimiento, como el acortamiento de los extremos de los cromosomas, conocidos como telómeros. Además, el equipo de Izpisua Belmonte está desarrollando tecnologías de edición epigenética para revertir alteraciones epigenéticas con un papel en el envejecimiento y la enfermedad humana.
Otros autores del artículo incluyen: Weiqi Zhang, Jingyi Li, Keiichiro Suzuki, Jing Qu, Ping Wang, Junzhi Zhou, Xiaomeng Liu, Ruotong Ren, Xiuling Xu, Alejandro Ocampo, Tingting Yuan, Jiping Yang, Ying Li, Liang Shi, Dee Guan, Huize Pan, Shunlei Duan, Zhichao Ding, Mo Li, Fei Yi, Ruijun Bai, Yayu Wang, Chang Chen, Fuquan Yang, Xiaoyu Li, Zimei Wang, Emi Aizawa, April Goebl, Rupa Devi Soligalla, Pradeep Reddy, Concepción Rodríguez Esteban, Fuchou Tang y Guang-Hui Liu.
El financiamiento para el estudio fue proporcionado por el Fundación Glenn, la Fundación benéfica G. Harold y Leila Y. Mathers y del Leona M. y Harry B. Helmsley Charitable Trust.
Sobre el Instituto Salk de Estudios Biológicos:
El Instituto Salk de Estudios Biológicos es una de las instituciones de investigación básica más importantes del mundo, donde profesores de renombre internacional investigan cuestiones fundamentales de las ciencias de la vida en un entorno único, colaborativo y creativo. Centrados tanto en el descubrimiento como en la orientación de futuras generaciones de investigadores, los científicos de Salk realizan contribuciones innovadoras a nuestra comprensión del cáncer, el envejecimiento, el Alzheimer, la diabetes y las enfermedades infecciosas mediante el estudio de la neurociencia, la genética, la biología celular y vegetal y disciplinas relacionadas.
Los logros de la facultad han sido reconocidos con numerosos honores, incluidos premios Nobel y membresías en la Academia Nacional de Ciencias. Fundado en 1960 por el pionero de la vacuna contra la polio Jonas Salk, MD, el Instituto es una organización independiente sin fines de lucro y un hito arquitectónico.
PERIODICO
Ciencia:
AUTORES
Weiqi Zhang, Jingyi Li, Keiichiro Suzuki, Jing Qu, Ping Wang, Junzhi Zhou, Xiaomeng Liu, Ruotong Ren, Xiuling Xu, Alejandro Ocampo, Tingting Yuan, Jiping Yang, Ying Li, Liang Shi, Dee Guan, Huize Pan, Shunlei Duan , Zhichao Ding, Mo Li, Fei Yi, Ruijun Bai, Yayu Wang, Chang Chen, Fuquan Yang, Xiaoyu Li, Zimei Wang, Emi Aizawa, April Goebl, Rupa Devi Soligalla, Pradeep Reddy, Concepcion Rodriguez Esteban, Fuchou Tang, Guang- Hui Liu, Juan Carlos Izpisúa Belmonte
Oficina de Comunicaciones
Tel: (858) 453-4100
prensa@salk.edu