
6 de noviembre.
Los investigadores regeneran y curan los corazones de los ratones utilizando la maquinaria molecular que los animales tenían desde el principio.
Los investigadores regeneran y curan los corazones de los ratones utilizando la maquinaria molecular que los animales tenían desde el principio.
LA JOLLA–Investigadores del Instituto Salk han curado corazones lesionados de ratones vivos mediante la reactivación de maquinaria molecular inactiva durante mucho tiempo que se encuentra en las células de los animales, un hallazgo que podría ayudar a allanar el camino hacia nuevas terapias para trastornos cardíacos en humanos.
Los nuevos resultados, publicados el 6 de noviembre de 2014 en la revista Cell Stem Cell, sugieren que aunque los mamíferos adultos normalmente no regeneran el tejido dañado, pueden conservar una capacidad latente como remanente, como sus ancestros lejanos en el árbol evolutivo. Cuando los investigadores de Salk bloquearon cuatro moléculas que se pensaba que suprimían estos programas para la regeneración de órganos, vieron una mejora drástica en la regeneración y curación del corazón en los ratones.
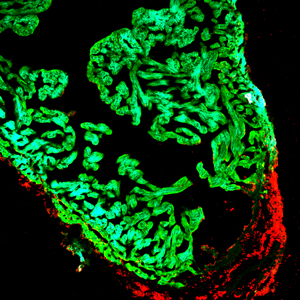
Un corazón de pez cebra lesionado que muestra células en proliferación en el área lesionada del corazón (rojo) y células del músculo cardíaco (verde).
Haga clic aquí para una imagen de alta resolución.
Imagen: Cortesía del Instituto Salk de Estudios Biológicos
Los hallazgos proporcionan una prueba de concepto para un nuevo tipo de tratamiento clínico en la lucha contra la enfermedad cardíaca, que mata a unas 600,000 personas cada año en los Estados Unidos, más que el SIDA y todos los tipos de cáncer combinados, según el Centros para el Control y la Prevención de Enfermedades.
“La regeneración de órganos es un fenómeno fascinante que aparentemente recapitula los procesos observados durante el desarrollo. Sin embargo, a pesar de nuestra comprensión actual de cómo procede la embriogénesis y el desarrollo, los mecanismos que impiden la regeneración en los mamíferos adultos siguen siendo esquivos”, dice el autor principal del estudio. Juan Carlos Izpisúa Belmonte, un profesor en el Laboratorio de Expresión Génica en Salk y titular de la Cátedra Roger Guillemin.
Dentro de los genomas de cada célula de nuestro cuerpo, tenemos la información que necesitamos para generar un órgano. El grupo de Izpisua Belmonte se ha centrado durante muchos años en dilucidar las moléculas clave implicadas en el desarrollo embrionario, así como las posibles respuestas curativas subyacentes en organismos regenerativos como el pez cebra.
De hecho, allá por 2003, el laboratorio de Izpisua Belmonte identificó por primera vez las señales que preceden a la regeneración del corazón del pez cebra. Y en un 2010 Naturaleza artículo, los investigadores describieron cómo se produjo la regeneración en el pez cebra. En lugar de que las células madre invadieran el tejido cardíaco lesionado, las propias células cardíacas volvían a un estado similar al precursor (un proceso llamado "desdiferenciación") que, a su vez, les permitía proliferar en el tejido.
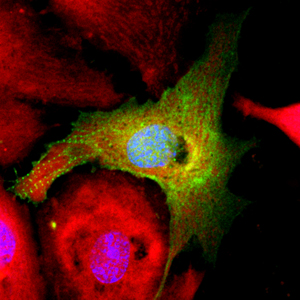
En una placa, las células del músculo cardíaco vuelven a un estado similar al precursor después del tratamiento pro-regenerativo con inhibidores de microARN. El verde muestra un citoesqueleto de cardiomiocitos desorganizado indicativo de desdiferenciación celular; el rojo muestra la organización mitocondrial.
Haga clic aquí para una imagen de alta resolución.
Imagen: Cortesía del Instituto Salk de Estudios Biológicos
Aunque en teoría podría haber parecido el siguiente paso lógico preguntar si los mamíferos habían conservado evolutivamente alguno de los jugadores moleculares correctos para este tipo de reprogramación regenerativa, en la práctica era un riesgo científico, recuerda Ignacio Sancho-Martínez, investigador postdoctoral en Laboratorio de Izpisua Belmonte.
“Cuando hablas de estas cosas, lo primero que le viene a la mente a la gente es que estás loco”, dice. "Es una idea que suena extraña, ya que asociamos la regeneración con salamandras y peces, pero no con mamíferos".
La mayoría de los otros estudios han buscado pistas moleculares sobre la proliferación en los corazones de los mamíferos recién nacidos, sin éxito. “En cambio, pensamos: 'Si los peces saben cómo hacerlo, debe haber algo que puedan enseñarnos al respecto'”, dice el primer autor del estudio, Aitor Aguirre, investigador postdoctoral en el grupo de Izpisua Belmonte.
El equipo decidió centrarse en los microARN, en parte porque estas cadenas cortas de ARN controlan la expresión de muchos genes. Realizaron un cribado exhaustivo de los microARN cuyos niveles de expresión estaban cambiando durante la curación del corazón del pez cebra y que también se conservaron en el genoma de los mamíferos.
Sus estudios descubrieron cuatro moléculas en particular, MiR-99, MiR-100, Let-7a y Let-7c, que se ajustan a sus criterios. Todos fueron fuertemente reprimidos durante la lesión cardíaca en el pez cebra y también estuvieron presentes en ratas, ratones y humanos.

De izquierda a derecha: Alejandro Ocampo, Concepción Rodríguez Esteban, Juan Carlos Izpisua Belmonte, Ignacio Sancho-Martínez, Tomoaki Hishida y Eric Vázquez.
Haga clic aquí para una imagen de alta resolución.
Imagen: Cortesía del Instituto Salk de Estudios Biológicos
Sin embargo, en estudios de células de mamíferos en una placa de cultivo y estudios de ratones vivos con daño cardíaco, el grupo vio que los niveles de estas moléculas eran altos en adultos y no disminuían con la lesión. Entonces, el equipo usó virus adenoasociados específicos para el corazón para atacar cada uno de esos cuatro microARN, suprimiendo sus niveles experimentalmente.
La inyección de los inhibidores en el corazón de ratones que habían sufrido un infarto desencadenó la regeneración de las células cardíacas, mejorando numerosos aspectos físicos y funcionales del corazón, como el grosor de sus paredes y su capacidad para bombear sangre. La cicatrización causada por el ataque cardiaco se redujo mucho con el tratamiento en comparación con los controles, hallaron los investigadores.
Las mejoras seguían siendo evidentes tres y seis meses después del tratamiento, mucho tiempo en la vida de un ratón. “Lo bueno es que el éxito no se limitó al corto plazo, que es bastante común en la biología regenerativa cardíaca”, dice Sancho-Martínez.
El nuevo estudio se centró solo en un puñado de 70 candidatos a microARN que aparecieron en la pantalla inicial del grupo. Es probable que estas otras moléculas también desempeñen un papel en la proliferación de células cardíacas, la curación de cicatrices y la promoción de la formación de nuevos vasos sanguíneos, todos procesos críticos para la reparación del corazón, dice Sancho-Martínez. Los datos están disponibles para que otros grupos de investigación puedan centrarse en las moléculas que les interesan.
El próximo paso para el equipo de Izpisua Belmonte es pasar a animales más grandes y ver si la "reprogramación regenerativa" puede funcionar en corazones más grandes y durante períodos prolongados después del tratamiento, dice Sancho-Martínez. Y, aunque el empaque del virus desapareció de los cuerpos de los animales dos semanas después del tratamiento, los científicos están trabajando en una nueva forma de administrar los inhibidores para evitar por completo la necesidad de virus.
Otros autores del estudio incluyen a Nuria Montserrat del Centro de Medicina Regenerativa de Barcelona (CMRB), Barcelona, España; Josep Maria Campistol del Hospital Clinic, Barcelona, España; Serena Zachiggna y Mauro Giacca del Centro Internacional de Ingeniería Genética y Biotecnología en Trieste, Italia; Emmanuel Nivet, Tomoaki Hishida, Marie Nicole Krause, Leo Kurian, Alejandro Ocampo, Eric Vazquez-Ferrer, Concepcion Rodriguez-Esteban y Sachin Kumar del Salk Institute for Biological Studies; y James Moresco y John Yates III del Instituto de Investigación Scripps en La Jolla, California.
El trabajo fue apoyado por el Fundación Ipsen; El Instituto de California para la medicina regenerativa; Un Fundación Nomis beca posdoctoral; el Instituto Nacional del Corazón, los Pulmones y la Sangre; El Fundación benéfica G. Harold y Leila Y. Mathers; y La Fundación Benéfica Leona M. y Harry B. Helmsley.
Sobre el Instituto Salk de Estudios Biológicos:
El Instituto Salk de Estudios Biológicos es una de las instituciones de investigación básica más importantes del mundo, donde profesores de renombre internacional investigan cuestiones fundamentales de las ciencias de la vida en un entorno único, colaborativo y creativo. Centrados tanto en el descubrimiento como en la orientación de futuras generaciones de investigadores, los científicos de Salk realizan contribuciones innovadoras a nuestra comprensión del cáncer, el envejecimiento, el Alzheimer, la diabetes y las enfermedades infecciosas mediante el estudio de la neurociencia, la genética, la biología celular y vegetal y disciplinas relacionadas.
Los logros de la facultad han sido reconocidos con numerosos honores, incluidos premios Nobel y membresías en la Academia Nacional de Ciencias. Fundado en 1960 por el pionero de la vacuna contra la polio Jonas Salk, MD, el Instituto es una organización independiente sin fines de lucro y un hito arquitectónico.
PERIODICO
Cell Stem Cell
AUTORES
Aitor Aguirre, Nuria Montserrat, Serena Zachiggna, Emmanuel Nivet, Tomoaki Hishida, Marie Nicole Krause, Leo Kurian, Alejandro Ocampo, Eric Vazquez-Ferrer, Concepcion Rodriguez-Esteban, Sachin Kumar, James J. Moresco, John R. Yates III, Josep María Campistol, Ignacio Sancho-Martínez, Mauro Giacca and Juan Carlos Izpisua Belmonte
Oficina de Comunicaciones
Tel: (858) 453-4100
prensa@salk.edu