
18 de Julio de 2013
El nuevo método debería acelerar la promesa de la medicina regenerativa
El nuevo método debería acelerar la promesa de la medicina regenerativa
LA JOLLA, CA—Las células madre son clave para la promesa de la medicina regenerativa: la reparación o el reemplazo de tejidos lesionados con sustitutos cultivados a medida. Esencial para este proceso son las células madre pluripotentes inducidas (iPSC), que se pueden crear a partir de los propios tejidos del paciente, eliminando así el riesgo de rechazo inmunológico. Sin embargo, la fórmula de Shinya Yamanaka para las iPSC, por la que recibió el Premio Nobel el año pasado, utiliza una receta estricta que permite variaciones limitadas en las células humanas, lo que restringe todo su potencial para la aplicación clínica.
Ahora, en la edición de esta semana de Cell Stem Cell, el Instituto Salk Juan Carlos Izpisúa Belmonte y sus colegas muestran que la receta de las iPSC es mucho más versátil de lo que se pensaba originalmente. Por primera vez, han reemplazado un gen que alguna vez se consideró imposible de sustituir, creando el potencial para recetas más flexibles que deberían acelerar la adopción de terapias con células madre.

Desde la izquierda: Emmanuel Nivet y Juan Carlos Belmonte. Sentados: Ignacio Sancho Martínez
Imagen: Cortesía del Instituto Salk de Estudios Biológicos
Las células madre vienen en dos tipos: células madre embrionarias (ESC), que son células inmaduras que nunca se han diferenciado en tipos de células específicas, y células madre pluripotentes inducidas, que son células maduras que se han reprogramado a un estado indiferenciado. Después del descubrimiento inicial en 2006 por parte de Yamanaka de que la introducción de cuatro genes diferentes en una célula madura podría ser suficiente para reprogramar la célula a la pluripotencia, la mayoría de los investigadores adoptaron su receta.
Izpisua Belmonte y sus colegas adoptaron un nuevo enfoque y descubrieron que la pluripotencia (la capacidad de las células madre para diferenciarse en casi cualquier tipo de célula adulta) también se puede lograr equilibrando los genes necesarios para la diferenciación. Estos genes codifican "factores de transcripción de linaje", proteínas que inician una célula madre en el camino para diferenciarse primero en un linaje o tipo de célula en particular, como una célula sanguínea versus una célula de la piel, y luego finalmente en una célula específica, como como glóbulo blanco.
“Antes de esta serie de experimentos, la mayoría de los investigadores en el campo partieron de la premisa de que estaban tratando de imponer un estado 'similar al embrionario' en las células maduras”, dice Izpisua Belmonte, quien ocupa la Cátedra Roger Guillemin del Instituto. "En consecuencia, los principales esfuerzos se han centrado en la identificación de factores que son típicos de las células madre embrionarias naturales, que permitirían o mejorarían aún más la reprogramación".
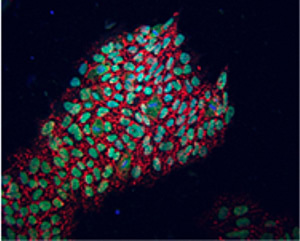
Por primera vez, el laboratorio de Belmonte ha reemplazado a OCT4, un gen que antes se consideraba indispensable para la reprogramación de células humanas en células de tipo embrionario.
La imagen muestra células recién reprogramadas que expresan marcas de pluripotencia identificadas por fluorescencia (NANOG en verde, TRA-1-81 en rojo).
Imagen: Cortesía del Instituto Salk de Estudios Biológicos
A pesar de estos esfuerzos, no parecía haber forma de determinar a través de la identidad genética únicamente que las células eran pluripotentes. En cambio, la pluripotencia se evaluó de forma rutinaria mediante ensayos funcionales. En otras palabras, si actúa como una célula madre, debe ser una célula madre.
Esa condición llevó al equipo a su idea clave. “La pluripotencia no parece representar una entidad celular discreta, sino un estado funcional provocado por un equilibrio entre fuerzas de diferenciación opuestas”, dice Izpisua Belmonte.
Una vez que entendieron esto, se dieron cuenta de que los cuatro genes adicionales no eran necesarios para la pluripotencialidad. En cambio, podría lograrse alterando el equilibrio de los "especificadores de linaje", genes que ya estaban en la célula y que especificaban en qué tipo de tejido adulto podría convertirse una célula.
"Una de las implicaciones de nuestros hallazgos es que la identidad de las células madre en realidad no es fija, sino un equilibrio que se puede lograr mediante múltiples combinaciones diferentes de factores que no son necesariamente típicos de las ESC", dice Ignacio Sancho-Martínez, uno de los primeros autores del artículo e investigador postdoctoral en Laboratorio de Izpisua Belmonte.
El grupo pudo demostrar que más de siete genes adicionales pueden facilitar la reprogramación de las iPSC. Lo que es más importante, por primera vez en células humanas, pudieron reemplazar un gen de la receta original llamado Oct4, que había sido reemplazado en células de ratón, pero que aún se consideraba indispensable para la reprogramación de células humanas. Su capacidad para reemplazarlo, así como SOX2, otro gen que alguna vez se consideró esencial y que nunca se había reemplazado en combinación con Oct4, demostró que el desarrollo de células madre debe verse de una manera completamente nueva.
"En general, se suponía que el desarrollo conducía a la especificación de células/tejidos al 'abrir' ciertas puertas de diferenciación", dice Emmanuel Nivet, investigador postdoctoral en el laboratorio de Izpisua Belmonte y coautor del artículo, junto con Sancho-Martinez y Nuria Montserrat de la Centro de Medicina Regenerativa en Barcelona, España.
En cambio, la sustitución exitosa de Oct4 y SOX2 muestra lo contrario. “La pluripotencialidad es como una habitación con todas las puertas abiertas, en la que la diferenciación se logra 'cerrando' las puertas”, dice Nivet. “Inversamente, la reprogramación a la pluripotencia se logra abriendo puertas”.
El equipo cree que su trabajo debería ayudar a superar uno de los principales obstáculos para la adopción generalizada de terapias con células madre: los cuatro genes originales utilizados para reprogramar las células madre estaban implicados en el cáncer. “Estudios recientes en cáncer, muchos de ellos realizados por mis colegas de Salk, han mostrado similitudes moleculares entre la proliferación de células madre y células cancerosas, por lo que no sorprende que los oncogenes [genes relacionados con el cáncer] sean parte de la receta de iPSC. ”, dice Izpisúa Belmonte.
Con este nuevo método, que permite una receta personalizada, el equipo espera impulsar la investigación terapéutica. "Dado que hemos demostrado que es posible reemplazar genes que se consideraban esenciales para la reprogramación con varios genes diferentes que no habían estado involucrados previamente en la tumorigénesis, esperamos que este estudio permita que la investigación de iPSC se traduzca más rápidamente en la clínica", dice Izpisúa Belmonte.
Otros investigadores del estudio fueron Tomoaki Hishida, Sachin Kumar, Yuriko Hishida, Yun Xia y Concepción Rodríguez Esteban del Instituto Salk; Laia Miquel y Carme Cortina de la Centro de Medicina Regenerativa en Barcelona, España.
El trabajo fue apoyado por el Leona M. y Harry B. Helmsley Charitable Trust, Fundación FM Kirby, la Fundación benéfica G. Harold y Leila Y. Mathers, Fundación Nomis, Fundación Cellex, la Ministerio de Economía y Competitividad (MINECO), TERCEL-ISCIII-MINECO y Cardiocel.
Sobre el Instituto Salk de Estudios Biológicos:
El Instituto Salk de Estudios Biológicos es una de las instituciones de investigación básica más importantes del mundo, donde profesores de renombre internacional investigan cuestiones fundamentales de las ciencias de la vida en un entorno único, colaborativo y creativo. Centrados tanto en el descubrimiento como en la orientación de futuras generaciones de investigadores, los científicos de Salk realizan contribuciones innovadoras a nuestra comprensión del cáncer, el envejecimiento, el Alzheimer, la diabetes y las enfermedades infecciosas mediante el estudio de la neurociencia, la genética, la biología celular y vegetal y disciplinas relacionadas.
Los logros de la facultad han sido reconocidos con numerosos honores, incluidos premios Nobel y membresías en la Academia Nacional de Ciencias. Fundado en 1960 por el pionero de la vacuna contra la polio Jonas Salk, MD, el Instituto es una organización independiente sin fines de lucro y un hito arquitectónico.
PERIODICO
Cell Stem Cell
AUTORES
Emmanuel Nivet, Ignacio Sancho-Martínez, Tomoaki Hishida, Sachin Kumar, Yuriko Hishida, Yun Xia, Concepción Rodríguez Esteban y Juan Carlos Izpisua Belmonte del Instituto Salk; Nuria Montserrat, Laia Miquel y Carme Cortina del Centro de Medicina Regenerativa de Barcelona, España
Oficina de Comunicaciones
Tel: (858) 453-4100
prensa@salk.edu