
7 de septiembre de 2018
Investigadores del Instituto Salk y la Universidad de Florida visualizan un virus con mejor resolución que nunca antes
Investigadores del Instituto Salk y la Universidad de Florida visualizan un virus con mejor resolución que nunca antes
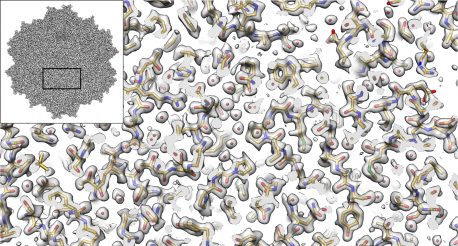
LA JOLLA—El método de imagen llamado microscopía crioelectrónica (cryo-EM) permite a los investigadores visualizar las formas de las moléculas biológicas con un nivel de detalle sin precedentes. Ahora, un equipo dirigido por investigadores del Instituto Salk y la Universidad de Florida informa cómo usaron crio-EM para mostrar la estructura de una versión de un virus llamado AAV2, mejorando las capacidades de la técnica y el potencial del virus como vehículo de distribución. para terapias génicas.
"No es una exageración decir que esta es una de las mejores estructuras crio-EM que jamás se haya logrado en este campo", dice el profesor asistente de Salk. Dmitri Lyumkis, biólogo estructural y coautor principal del estudio. “Aplicamos una serie de procedimientos diferentes que anteriormente solo se habían descrito en teoría. Demostramos experimentalmente, por primera vez, que pueden usarse para mejorar drásticamente la calidad de este tipo de imágenes”.
Haga clic aquí para una imagen de alta resolución.
Crédito: Instituto Salk
Los investigadores utilizaron varios avances técnicos para crear una representación tridimensional de una variante AAV2 (abreviatura de serotipo 2 del virus adenoasociado), con una resolución mucho mejor que nunca antes. El estudio, que se informó en Nature Communications el 7 de septiembre de 2018, está avanzando en las aplicaciones metodológicas de crio-EM al tiempo que ayuda a desarrollar mejores terapias génicas, incluidos tratamientos para algunos tipos hereditarios de ceguera, hemofilia y enfermedades del sistema nervioso.
Cryo-EM ha permitido a los investigadores observar el funcionamiento interno de estructuras diminutas y está cambiando nuestra comprensión de las biomoléculas y sus mecanismos. En el trabajo actual, los autores muestran que la técnica es realmente capaz de alcanzar resoluciones casi hasta el nivel de un solo átomo. También permite a los investigadores derivar estructuras para complejos de proteínas completos, en lugar de solo porciones de proteínas.
En el nuevo estudio, los investigadores de Salk se centraron en una versión de un virus AAV2 que tiene un cambio particular en uno de sus aminoácidos. Esta versión es interesante porque es menos infecciosa que otros AAV y está siendo estudiada por sus importantes implicaciones en el ciclo de vida viral. La nueva investigación proporcionó una explicación estructural de por qué es diferente de otros virus, al revelar cambios clave en el portal viral utilizado para empaquetar el ADN.
Dichos estudios informarán las aplicaciones de terapia génica en las que un gen correctivo para una enfermedad se transporta dentro de un virus, que entrega el gen a una célula. La terapia génica se está estudiando para una serie de enfermedades causadas por mutaciones únicas, incluida la amaurosis congénita de Leber, la distrofia muscular de Duchenne, la anemia de células falciformes, la epidermólisis ampollosa de la unión y la hemofilia, entre otras.
“En última instancia, este tipo de investigación tiene implicaciones importantes para comprender las interacciones entre estos diferentes virus y los tipos de células que infectan”, dice Sriram Aiyer, investigador asociado en el laboratorio de Lyumkis y uno de los primeros autores del estudio. “Esto es importante para desarrollar una mayor comprensión del sistema inmunitario humano y cómo reconoce los virus”.

Haga clic aquí para una imagen de alta resolución.
Crédito: Instituto Salk
La profesora Mavis Agbandje-McKenna, directora del Centro de Biología Estructural de la Universidad de Florida y coautora principal del artículo, agrega: “Esta técnica será especialmente importante para desarrollar una mejor comprensión de cómo estos virus interactúan con el sistema inmunológico humano. , que es uno de los principales obstáculos restantes para la utilización de estos virus en aplicaciones de terapia génica”.
El tamaño y la forma de AAV2 lo hicieron ideal para el análisis crio-EM actual. “Debido a que este virus tiene un alto nivel de simetría, nos dio más por el dinero”, dice Lyumkis. "Pudimos obtener 60 veces más información, lo que nos permite aplicar nuevas técnicas computacionales para crear una mejor reconstrucción de la molécula que será extensible a muchos futuros experimentos crio-EM de alta resolución".
Lyumkis dice que las técnicas de generación de datos ilustradas en este estudio muestran que es posible extrapolar los hallazgos con microscopios de menor voltaje que los requeridos anteriormente. En el futuro, esto permitirá a los investigadores utilizar nuevas versiones de instrumentos crio-EM que cuestan menos. “Los microscopios crio-EM son muy costosos y no muchas instituciones los tienen en este momento. Estos hallazgos ayudarán a abrir este campo a casi cualquier institución académica que realice investigación en biología estructural”, señala.
Otros investigadores del artículo fueron Yong Zi Tan de la Universidad de Columbia; Mario Mietzsch, Joshua A. Hull y Robert McKenna de la Universidad de Florida; Joshua Grieger y R. Jude Samulski de la Universidad de Carolina del Norte-Chapel Hill; y Timothy S. Baker de la Universidad de California en San Diego.
Este trabajo fue financiado por la Agencia para la Ciencia, la Tecnología y la Investigación de Singapur y las subvenciones de los Institutos Nacionales de Salud GM109524, R01GM033050, R01AI136680 y DP5OD021396.
PERIODICO
Nature Communications
AUTORES
Yong Zi Tan, Sriram Aiyer, Mario Mietzsch, Joshua A. Hull, Robert McKenna, Joshua Grieger, R. Jude Samulski, Timothy S. Baker, Mavis Agbandje-McKenna, Dmitry Lyumkis
Oficina de Comunicaciones
Tel: (858) 453-4100
prensa@salk.edu
Descubrir los secretos de la vida misma es la fuerza impulsora detrás del Instituto Salk. Nuestro equipo de científicos galardonados de clase mundial traspasa los límites del conocimiento en áreas como neurociencia, investigación del cáncer, envejecimiento, inmunobiología, biología vegetal, biología computacional y más. Fundado por Jonas Salk, desarrollador de la primera vacuna contra la polio segura y eficaz, el Instituto es una organización de investigación independiente y sin fines de lucro y un hito arquitectónico: pequeño por elección, íntimo por naturaleza y valiente ante cualquier desafío.