
2 de agosto de 2017
Los científicos logran la primera reparación segura de una mutación de un solo gen en embriones humanos
Los científicos logran la primera reparación segura de una mutación de un solo gen en embriones humanos
LA JOLLA—Los científicos, por primera vez, han corregido una mutación causante de enfermedades en embriones humanos en etapa temprana con edición de genes. La técnica, que utiliza el sistema CRISPR-Cas9, corrigió la mutación de una afección cardíaca en la etapa más temprana del desarrollo embrionario para que el defecto no se transmita a las generaciones futuras.
La obra, que se describe en Naturaleza el 2 de agosto de 2017, es una colaboración entre el Instituto Salk, la Universidad de Ciencias y Salud de Oregón (OHSU) y el Instituto de Ciencias Básicas de Corea y podría allanar el camino para mejorar los resultados de la fertilización in vitro (FIV), así como posibles curas para algunos de las miles de enfermedades causadas por mutaciones en genes únicos.
“Gracias a los avances en las tecnologías de células madre y la edición de genes, finalmente estamos comenzando a abordar las mutaciones que causan enfermedades que impactan potencialmente a millones de personas”, dice Juan Carlos Izpisúa Belmonte, profesor en el Laboratorio de Expresión Génica de Salk y autor correspondiente del artículo. “La edición de genes aún está en pañales, por lo que, aunque se descubrió que este esfuerzo preliminar fue seguro y eficaz, es fundamental que sigamos procediendo con la máxima cautela, prestando la máxima atención a las consideraciones éticas”.
Aunque las herramientas de edición de genes tienen el poder de curar potencialmente una serie de enfermedades, los científicos han procedido con cautela, en parte para evitar introducir mutaciones no deseadas en la línea germinal (células que se convierten en óvulos o espermatozoides). Izpisua Belmonte está excepcionalmente calificada para hablar sobre la ética de la edición del genoma en parte porque, como miembro de la comité de edición de genes humanos de las Academias Nacionales de Ciencias, Ingeniería y Medicina, ayudó a redactar la hoja de ruta de 2016 “Edición del genoma humano: ciencia, ética y gobernanza”. La investigación en el estudio actual cumple totalmente con las recomendaciones hechas en ese documento y se adhiere estrechamente a las pautas establecidas por la Junta de Revisión Institucional de OHSU y los comités ad-hoc adicionales establecidos para la revisión científica y ética.
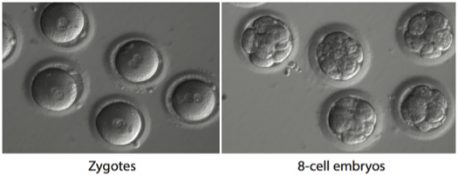
Haga clic aquí para una imagen de alta resolución.
Crédito: OHSU/laboratorio de Mitalipov
La miocardiopatía hipertrófica (MCH) es la causa más común de muerte súbita en atletas jóvenes sanos y afecta aproximadamente a 1 de cada 500 personas en general. Es causada por una mutación dominante en el MYBPC3 gen, pero a menudo pasa desapercibido hasta que es demasiado tarde. Dado que las personas con una copia mutante del MYBPC3 gen tiene un 50 por ciento de posibilidades de transmitirlo a sus propios hijos, ser capaz de corregir la mutación en los embriones evitaría la enfermedad no solo en los niños afectados, sino también en sus descendientes.
Los investigadores generaron células madre pluripotentes inducidas a partir de una biopsia de piel donada por un hombre con MCH y desarrollaron una estrategia de edición de genes basada en CRISPR-Cas9 que apuntaría específicamente a la copia mutada del MYBPC3 gen para la reparación. El objetivo mutado MYBPC3 La enzima Cas9 cortó el gen, lo que permitió que los propios mecanismos de reparación del ADN de las células del donante corrigieran la mutación durante la siguiente ronda de división celular mediante el uso de una secuencia de ADN sintética o la copia no mutada de MYBPC3 gen como plantilla.
Usando técnicas de FIV, los investigadores inyectaron los componentes de edición de genes de mejor rendimiento en óvulos de donantes sanos recién fertilizados con el esperma del donante. Luego analizaron todas las células en los primeros embriones con resolución de una sola célula para ver qué tan efectivamente se reparó la mutación.

Haga clic aquí para una imagen de alta resolución.
Crédito: Instituto Salk
Los científicos se sorprendieron de lo seguro y eficiente que era el método. No solo se reparó un alto porcentaje de células embrionarias, sino que la corrección de genes no indujo ninguna mutación fuera del objetivo detectable ni inestabilidad del genoma, las principales preocupaciones para la edición de genes. Además, los investigadores desarrollaron una estrategia robusta para garantizar que la reparación se produjera de manera uniforme en todas las células del embrión. (Las reparaciones irregulares pueden hacer que algunas células continúen portando la mutación).
“Aunque la tasa de éxito en células de pacientes cultivadas en un plato fue baja, vimos que la corrección genética parece ser muy sólida en embriones de los cuales una copia del MYBPC3 el gen está mutado”, dice Jun Wu, científico del personal de Salk y uno de los primeros autores del artículo. Esto se debió en parte a que, después del corte enzimático mediado por CRISPR-Cas9 de la copia del gen mutado, el embrión inició sus propias reparaciones. En lugar de usar la plantilla de ADN sintético provista, el equipo descubrió, sorprendentemente, que el embrión usaba preferentemente la copia sana disponible del gen para reparar la parte mutada. “Nuestra tecnología repara con éxito la mutación del gen que causa la enfermedad al aprovechar una respuesta de reparación del ADN exclusiva de los embriones tempranos”, dice Wu.
Izpisua Belmonte y Wu enfatizan que, aunque son prometedores, estos son resultados muy preliminares y será necesario realizar más investigaciones para garantizar que no se produzcan efectos no deseados.
“Nuestros resultados demuestran el gran potencial de la edición de genes embrionarios, pero debemos continuar evaluando de manera realista tanto los riesgos como los beneficios”, agrega Izpisua Belmonte.
El trabajo futuro continuará evaluando la seguridad y eficacia del procedimiento y la eficacia de la técnica con otras mutaciones.
Otros autores incluyeron: Keiichiro Suzuki del Instituto Salk; Hong Ma, Nuria Marti-Gutierrez, Yeonmi Lee, Amy Koski, Dongmei Ji, Tomonari Hayama, Riffat Ahmed, Hayley Darby, Crystal Van Dyken, Ying Li, Eunju Kang, David Battaglia, Sacha A. Krieg, David M. Lee, Diana H. Wu, Don P. Wolf, Stephen B. Heitner, Paula Amato, Sanjiv Kaul y Shoukhrat Mitalipov de Universidad de Salud y Ciencia de Oregon; Sang-Wook Park, A-Reum Park, Sang-Tae Kim y Jin-Soo Kim de Instituto de Ciencias Básicas de Corea; Daesik Kim de Universidad Nacional de Seúl; y Jianhui Gong, Ying Gu y Xun Xu de BGI, China.
El trabajo fue financiado por: Universidad de Ciencias y Salud de Oregón, la Instituto de Ciencias Básicas, el Fundación benéfica G. Harold y Leila Y. Mathers, el Fundación Moxie, el Leona M. y Harry B. Helmsley Charitable Trusty Gobierno Municipal de Shenzhen de China.
PERIODICO
Naturaleza
AUTORES
Hong Ma, Nuria Marti-Gutierrez, Sang-Wook Park, Jun Wu, Yeonmi Lee, Keiichiro Suzuki, Amy Koski, Dongmei Ji, Tomonari Hayama, Riffat Ahmed, Hayley Darby, Crystal Van Dyken, Ying Li, Eunju Kang, A-Reum Park, Daesik Kim, Sang-Tae Kim, Jianhui Gong, Ying Gu, Xun Xu, David Battaglia, Sacha A. Krieg, David M. Lee, Diana H. Wu, Don P. Wolf, Stephen B. Heitner, Juan Carlos Izpisua Belmonte, Paula Amato, Jin-Soo Kim, Sanjiv Kaul y Shoukhrat Mitalipov
Oficina de Comunicaciones
Tel: (858) 453-4100
prensa@salk.edu
Descubrir los secretos de la vida misma es la fuerza impulsora detrás del Instituto Salk. Nuestro equipo de científicos galardonados de clase mundial traspasa los límites del conocimiento en áreas como neurociencia, investigación del cáncer, envejecimiento, inmunobiología, biología vegetal, biología computacional y más. Fundado por Jonas Salk, desarrollador de la primera vacuna contra la polio segura y eficaz, el Instituto es una organización de investigación independiente y sin fines de lucro y un hito arquitectónico: pequeño por elección, íntimo por naturaleza y valiente ante cualquier desafío.