
30 de noviembre.
Nuevo método de imagen toma mezclas moleculares
Nuevo método de imagen toma mezclas moleculares
Haga clic aquí para una imagen de alta resolución
Crédito: Instituto Salk
LA JOLLA: los ribosomas, máquinas macromoleculares que consisten en ARN y proteínas que giran, se pliegan y giran, son responsables de producir todas las proteínas dentro de una célula y podrían ser la clave para descifrar una variedad de enfermedades. A pesar de las complejidades de los ribosomas, las células pueden producir 100,000 de ellos cada hora. Pero debido a que se ensamblan tan rápido, los investigadores no han podido averiguar cómo se unen.
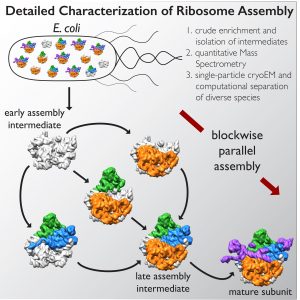
Una colaboración liderada por el Instituto Salk de Estudios Biológicos y el Instituto de Investigación Scripps en La Jolla, California, implementó un método de imágenes de vanguardia llamado microscopía crioelectrónica de partículas individuales (cryo-EM) y las herramientas de análisis que lo acompañan para descifrar algunos de los pasos clave sobre cómo se ensamblan los ribosomas, un primer paso para comprender sus funciones en la salud y la enfermedad. Los resultados se publican en línea el 1 de diciembre de 2016, en la revista Celular.
"Estas nuevas estructuras que capturamos con cryo-EM muestran que es posible obtener imágenes e interpretar diversas máquinas moleculares en acción", dice el coautor principal del estudio. Dmitri Lyumkis, becario Helmsley-Salk en Salk. “Esta es una forma completamente diferente de ver y hacer biología estructural. Este documento es un excelente ejemplo del hecho de que podemos hacer análisis mucho más complejos de lo que nunca se había esperado”.
Comprender las estructuras moleculares es importante no solo para la investigación básica en biología, sino también para el proceso de desarrollo de fármacos para comprender mejor cómo hacer medicamentos más seguros y efectivos. Los investigadores tradicionalmente recurren a la cristalografía de rayos X, un método que requiere que sus usuarios purifiquen extensamente una molécula y luego la rehagan en forma de cristal, pero este método tiene limitaciones.

Haga clic aquí para una imagen de alta resolución
Crédito: Instituto Salk
En los últimos años, los avances en crio-EM han permitido a los científicos obtener imágenes de partículas individuales con una resolución comparable a la de los métodos de rayos X tradicionales. Pero en la crio-EM de una sola partícula, las proteínas (las "partículas") se congelan instantáneamente y se obtienen imágenes utilizando flujos de electrones, lo que significa que las moléculas no necesitan cristalizarse y pueden retener gran parte de su estructura nativa. Aunque la crio-EM ha existido por un tiempo, las nuevas cámaras están facilitando la captura de proteínas en alta resolución antes de que el rocío de electrones las elimine.
Es importante destacar que las herramientas computacionales para analizar datos crio-EM han madurado de tal manera que los investigadores ahora pueden purificar moléculas. in silico por una computadora en lugar de a través de enfoques bioquímicos tradicionales. Esto se convierte en un enfoque mucho más poderoso para separar mezclas de especies, lo que permite a los investigadores identificar y distinguir poblaciones de partículas estructuralmente distintas con mayor detalle que antes.
En el nuevo estudio, el coautor principal James Williamson, profesor de biología molecular y química en el Instituto de Investigación Scripps, y su equipo desarrollaron un método para evitar que un componente principal de los ribosomas, la subunidad 50, se una tan rápido. Los científicos pudieron pausar químicamente una mezcla de diferentes moléculas en varias etapas de ensamblaje.
Luego, el grupo de Lyumkis usó crio-EM de alta gama para obtener imágenes y analizar estas estructuras estancadas, lo que no se había intentado para una mezcla de formas tan diversas de una molécula en particular.
“Otros han demostrado que puedes capturar un par de estados estructurales diferentes de una molécula”, dice Lyumkis. “Pero, hasta donde yo sé, nadie ha tratado de tomar esta mezcla cruda de cosas, ponerla en una rejilla crio-EM y preguntar qué había allí”.
Haga clic aquí para una imagen de alta resolución
Crédito: Instituto Salk
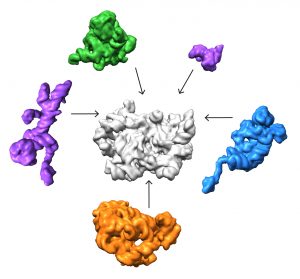
El equipo descubrió que hay al menos 15 tipos de complejos en la mezcla, 13 de los cuales están ensamblando activamente subunidades 50. Obtuvieron imágenes de cada una de estas estructuras a una resolución lo suficientemente alta como para descifrar los componentes de la proteína y el ARN. Luego pudieron usar algoritmos informáticos para ordenar los complejos de acuerdo con su ruta de ensamblaje.
El análisis del equipo sugiere que los ribosomas pueden tomar varias rutas diferentes para ensamblarse, lo cual es importante para garantizar que el proceso sea eficiente y pueda resistir una variedad de tensiones celulares, según Williamson. “Si imagina una línea de montaje en la que cada paso tiene que ocurrir en orden secuencial, y hay un problema en uno de esos pasos, todo se detiene”, dice. “Si hay caminos paralelos, entonces el montaje puede proceder por otros canales hasta que se resuelva el problema.
Los científicos tardaron más de un año en dar sentido a las estructuras, empleando herramientas de análisis de imágenes relativamente nuevas. Pero han sentado las bases para estudiar otras máquinas moleculares grandes, dinámicas y estructuralmente heterogéneas que, dice Lyumkis, conducirán a nuevos descubrimientos científicos básicos y traslacionales.
Otros autores del estudio son Joseph H. Davis de El Instituto de Investigación Scripps; y Yong Zi Tan, Bridget Carragher y Clinton Potter de Columbia Uiversity y del Centro de Biología Estructural de Nueva York.
La investigación fue apoyada por el Fundación infantil Jane Coffin; El Instituto Nacional de Envejecimiento; La Fundación Benéfica Leona M. y Harry B. Helmsley; El Instituto Nacional de Ciencias Médicas Generales; El Fundación Simons; y el Agencia de Ciencia, Tecnología e Investigación de Singapur.
PERIODICO
Celular
AUTORES
Joseph H. Davis, Yong Zi Tan, Bridget Carragher, Clinton S. Potter, Dmitry Lyumkis, James R. Williamson
Oficina de Comunicaciones
Tel: (858) 453-4100
prensa@salk.edu
Descubrir los secretos de la vida misma es la fuerza impulsora detrás del Instituto Salk. Nuestro equipo de científicos galardonados de clase mundial traspasa los límites del conocimiento en áreas como neurociencia, investigación del cáncer, envejecimiento, inmunobiología, biología vegetal, biología computacional y más. Fundado por Jonas Salk, desarrollador de la primera vacuna contra la polio segura y eficaz, el Instituto es una organización de investigación independiente y sin fines de lucro y un hito arquitectónico: pequeño por elección, íntimo por naturaleza y valiente ante cualquier desafío.