
12 de Octubre de 2009
LA JOLLA, CA—La corteza cerebral, el componente más grande y complejo del cerebro, es exclusiva de los mamíferos y es la única que ha desarrollado especializaciones humanas. Aunque al principio todas las células madre encargadas de construir la corteza cerebral, la capa más externa de las neuronas comúnmente conocida como materia gris, se crean de la misma manera, pronto se comprometen irrevocablemente a formar regiones corticales específicas. Pero cómo se determina el destino de las células madre sigue siendo una pregunta abierta.
En la edición en línea anticipada del 11 de octubre de Nature Neuroscience, científicos del Instituto Salk de Estudios Biológicos informan que han identificado el primer mecanismo genético que determina la identidad regional de los progenitores encargados de generar la corteza cerebral. Su descubrimiento revela un período crítico durante el cual un factor de transcripción de homeodominio LIM conocido como Lhx2 decide sobre el destino regional de los progenitores: una vez que se cierra la ventana de oportunidad, su destino está sellado.
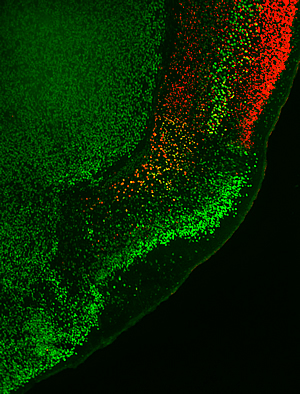
En los cerebros de ratones normales, la neocorteza de seis capas, indicada con el marcador rojo y que se muestra en la esquina superior derecha, está ubicada junto a la corteza olfativa de tres capas, indicada con el marcador verde brillante, que también marca la capa 5 de el neocórtex. Si falta Lhx2 durante un período crítico, la neocorteza se transforma en corteza olfativa.
Imagen: Cortesía del Dr. Shen-Ju Chou, Instituto Salk de Estudios Biológicos
“Estos hallazgos brindan una base para comprender el importante proceso de desarrollar las distintas regiones de la corteza cerebral y determinar sus propiedades únicas”, dice dennis o'leary, Ph.D., profesor en el Laboratorio de Neurobiología Molecular, quien dirigió el estudio.
Este conocimiento también ayudará potencialmente a comprender los fundamentos genéticos de muchos trastornos neurodegenerativos y proporcionará los medios para especificar de forma única las células madre para reparar partes específicas del cerebro devastadas por una enfermedad o lesión.
Durante el desarrollo del cerebro embrionario, las células madre que darán origen a la corteza cerebral pasan por una serie de etapas estrictamente reguladas: desde células madre omnipotentes hasta células progenitoras corticales que finalmente formarán regiones funcionalmente especializadas, como la neocorteza de seis capas, la la parte más grande y evolutivamente más reciente de la corteza cerebral, y la corteza olfativa de tres capas más antigua, entre otras.
Al principio de la neurogénesis, las células progenitoras similares a las células madre conocidas como células neuroepiteliales experimentan una división celular simétrica para expandir el grupo de células neuroepiteliales. Más tarde, se diferencian en células progenitoras más maduras denominadas glía radial, que se dividen asimétricamente para producir un flujo constante tanto de progenitores como de neuronas, estas últimas migran hacia el exterior para establecer la materia gris de las regiones corticales especializadas.
En un estudio publicado a principios de este año, O'Leary y Setsuko Sahara, Ph.D., investigador asociado sénior en el laboratorio de O'Leary, descubrieron que el factor de crecimiento Fgf10 controla el momento del período de transición crítico que une la expansión temprana fase de células neuroepiteliales y la fase neurogénica posterior de glía radial. Ahora, los investigadores de Salk querían saber cuándo y cómo estas células adquieren su futura identidad regional.
El modelo predominante para determinar los mecanismos genéticos que especifican la producción de distintos tipos de neuronas ha sido la médula espinal. “En la médula espinal, distintas subpoblaciones de progenitores que generan diferentes clases de neuronas están definidas por conjuntos únicos de factores de transcripción y están separadas por bordes espaciales nítidos”, explica O'Leary. “Pero en la corteza cerebral la situación es muy diferente. No hay genes que nosotros o cualquier otra persona haya identificado que definan subpoblaciones separadas de progenitores que generen neuronas que formen las diferentes regiones de la corteza cerebral. Por lo tanto, debe operar un mecanismo diferente”.
La característica definitoria de las células progenitoras que pasarán a formar la corteza cerebral es la expresión de Emx1, un factor de transcripción del homeodominio. O'Leary propuso que la identidad regional de los progenitores en el linaje Emx1 puede involucrar una expresión graduada de uno o más factores de transcripción que definen subpoblaciones únicas de progenitores a través de diferencias en sus niveles de expresión. El candidato más prometedor fue Lhx2, que se expresa en todos los progenitores del linaje Emx1 pero en diferentes niveles en un patrón graduado. Probar esta hipótesis requirió que Shen-ju Chou, Ph.D., investigador asociado senior en el laboratorio de O'Leary y primer autor de este estudio, desarrollara un nuevo ratón modificado genéticamente para eliminar Lhx2 de manera condicional.
Shen-ju y otros dos miembros del equipo de investigación de O'Leary, Carlos G. Pérez García, Ph.D. y Todd T. Kroll, Ph.D., luego usaron esta línea de ratón para eliminar Lhx2 en diferentes momentos durante el desarrollo embrionario para evaluar si Lhx2 tenía algo que decir sobre el destino de los progenitores en las regiones productoras de la corteza cerebral.
Cuando los investigadores eliminaron Lhx2 de las células neuroepiteliales antes de que hicieran la transición a la glía radial, la neocorteza se transformó en una gran corteza olfativa fuera de lugar. Pero cuando eliminaron Lhx2 solo un día después, la transformación no ocurrió, lo que indica que la identidad regional de los progenitores estaba fija.
“Estos experimentos muestran que Lhx2 regula la decisión del destino regional de los progenitores del linaje Emx1 para generar neocórtex o corteza olfativa”, dice Chou. “Lhx2 debe estar presente en cantidades adecuadas durante un período de tiempo crítico para que los progenitores tomen la decisión de destino adecuada. Agrega O'Leary: "Este hallazgo encaja muy bien con nuestro estudio anterior sobre Fgf10 al demostrar que la ventana de tiempo crítica para la decisión del destino regional determinada por Lhx2 se cierra una vez que las células neuroepiteliales han hecho la transición a la glía radial, un paso regulado por Fgf10".
El equipo de O'Leary planea ampliar este trabajo para determinar el mecanismo de acción de Lhx2 y si la modulación de los niveles de Lhx2 puede dirigir o restringir la diferenciación de células madre embrionarias (ES) o células madre pluripotentes inducidas (iPS). Este trabajo será importante para el desarrollo de estrategias para la reparación del cerebro.
Este trabajo fue apoyado por subvenciones de los Institutos Nacionales de Salud.
Acerca del Instituto Salk de Estudios Biológicos
El Instituto Salk de Estudios Biológicos es una de las instituciones de investigación básica más importantes del mundo, donde profesores de renombre internacional investigan cuestiones fundamentales de las ciencias de la vida en un entorno único, colaborativo y creativo. Centrados tanto en el descubrimiento como en la orientación de futuras generaciones de investigadores, los científicos de Salk realizan contribuciones innovadoras a nuestra comprensión del cáncer, el envejecimiento, el Alzheimer, la diabetes y los trastornos cardiovasculares mediante el estudio de la neurociencia, la genética, la biología celular y vegetal y disciplinas relacionadas.
Los logros de la facultad han sido reconocidos con numerosos honores, incluidos premios Nobel y membresías en la Academia Nacional de Ciencias. Fundado en 1960 por el pionero de la vacuna contra la polio Jonas Salk, MD, el Instituto es una organización independiente sin fines de lucro y un hito arquitectónico.
Oficina de Comunicaciones
Tel: (858) 453-4100
prensa@salk.edu